题目内容
【题目】氮化镁是一种应用范围非常广泛的无机化合物,它可用于制备高硬度、高热导、抗腐蚀、抗磨损和耐高温的其它元素的氮化物,制备特殊的陶瓷材料等。某校化学研究小组用镁与氮气反应制备氮化镁(Mg3N2),并用实验方法测定氮化镁的纯度。
I.制备氮化镁
【查阅资料】
①(NH4)2SO4+2NaNO2 ![]() 2N2↑+Na2SO4+4H2O,该反应为放热反应。
2N2↑+Na2SO4+4H2O,该反应为放热反应。
②饱和硫酸亚铁溶液能吸收氧气;稀硫酸能吸收氨气。
③在常温下或温度不高的条件下镁几乎与水不反应。
【实验】
制备氮化镁的装置示意图如下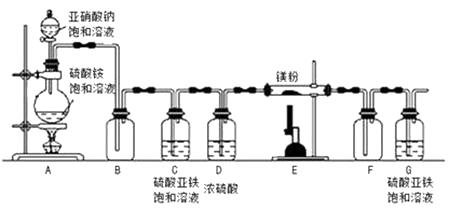
(1)D装置的作用是 , G装置的作用是。
(2)E装置中发生反应的化学方程式为。
(3)实验时先进行(选填“A”或“E”)处加热,理由是。
(4)II.测定氮化镁的含量
氮化镁是浅黄色粉末,极易与水反应生成Mg(OH)2沉淀和NH3 , 反应的化学方程式为 , 氮化镁(Mg3N2)中氮元素的化合价是。
(5)【定性分析】,
步骤一:取少量氮化镁样品于试管中加足量蒸馏水,试管底部有沉淀生成,试管口闻到有刺激性气味的气体生成。
步骤二:弃去上层清液,加入稀盐酸,观察到沉淀全溶且冒气泡。该步骤中产生气泡的化学方程式为。
(6)【定量测定】按下图实验装置进行实验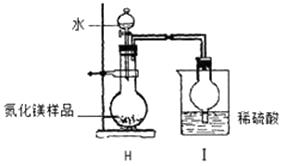 :
:
取氮化镁样品16g进行实验,I装置增重3.4g,求该样品中氮化镁的质量分数(请写出计算过程)。
(7)球形干燥管的作用是。
【答案】
(1)吸收水蒸气(或干燥氨气),防止空气中氧气进入E装置
(2)3Mg+N2 ![]() Mg3N2
Mg3N2
(3)A,排尽装置内的空气
(4)Mg3N2+6H2O=3Mg(OH)2+2NH3↑,-3
(5)Mg+2HCl=MgCl2+H2↑
(6)解:取氮化镁样品16g进行实验,I装置增重3.4g。稀硫酸能吸收氨气,故I装置增重的质量即为氮化镁与水反应生成的氨气的质量。氨气中氮元素的质量=3.4g×14/17 ×100% =2.8g ;根据质量守恒定律化学反应前后元素的质量不变,即氮化镁中氮元素的质量为2.8g,
那么氮化镁的质量=2.8g÷28/100 ×100% =10g
该样品中氮化镁的质量分数=10g/16g ×100% =62.5%
(7)充分反应,防止倒吸
【解析】(1)D装置中的浓硫酸,浓硫酸具有吸水性,能做干燥剂,故是起吸收水蒸汽的作用;空气中含有氧气,氧气能与镁反应,故G装置的主要作用是防止空气中氧气进入E装置;
(2)镁与氮气在点燃的条件生成氮化镁,即E装置中发生反应的化学方程式为:3Mg+N2 ![]() Mg3N2;
Mg3N2;
(3)由于装置中含有氧气,氧气能与氮气反应,故要先加热A装置,目的是排尽装置内的空气,以免发生干扰;
II.测定氮化镁的含量:根据描述可知氮化镁与水反应生成Mg(OH)2沉淀和NH3,故反应的化学方程式表示为:Mg3N2+6H2O=3Mg(OH)2+2NH3↑;根据“在化合物中,正负化合价的代数和为零”的原则,已知镁的化合价为+2价, 设氮元素的化合价为x,则(+2)×3+2x =0,解得x= -3 ;
【定性分析】取少量氮化镁样品于试管中加足量蒸馏水,试管底部有沉淀生成,试管口闻到有刺激性气味的气体生成,可知生成了氨气;弃去上层清液,加入稀盐酸,观察到沉淀全溶且冒气泡。根据质量守恒定律化学反应前后元素的种类不变可知,由于氮化镁中不含碳元素,故不可能生成碳酸镁。先加入稀盐酸发生了气泡,故沉淀一定是镁,镁与稀盐酸反应生成氯化镁和氢气:Mg+2HCl=MgCl2+H2↑;
【定量测定】球形干燥管的主要作用是使稀硫酸与氨气充分反应,并可起防止倒吸的作用。
(1)装置内含有氧气、反应生成的气体中可能含有氮的氧化物,装置C除去氧气(及氮氧化物)、D干燥氮气,防止对E装置反应的影响;装置G防止空气中氧气进入E装置;(2)装置E中氮气与镁反应生成氮化镁;(3)进行实验时先进行A处加热,为了排尽空气,防止镁和空气发生反应;(4)
氮化镁和水是反应物,生成了Mg(OH)2沉淀和NH3,据此书写化学方程式;在化合物中,正负化合价的代数和为零;根据氮化镁水解生成氢氧化镁沉淀与氨气,氨气使湿润的红色石蕊试纸变蓝,据此设计证明有氮化镁生成;若Mg有剩余,将上述反应后的上清液去掉,加入盐酸,有气泡生成,说明有Mg剩余解答;(4)根据I装置增重3.4克为氨气的质量,利用化学方程式分析解答;(5)根据球形干燥管的作用是充分反应,防倒吸解答.

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案