题目内容
【题目】某兴趣小组的同学欲确定一包久置的氢氧化钠固体的成份,进行了下列实验探究.
(1)另取少量固体样品于试管中,加水溶解后,滴入酚酞溶液,变红色,则该样品中NaOH(选填“一定有”、“可能有”、“一定没有”)
(2)再取少量固体样品加水溶解,在密闭装置中逐滴加入稀盐酸,测得气体质量与所加稀盐酸关系如图所示,在加入稀盐酸10g后,溶液中的溶质有
(3)通过计算求出稀盐酸的质量分数.
(4)请分析,一定质量的NaOH固体,变质前后与相同质量分数的稀盐酸反应,变质前消耗的盐酸的量变质后消耗的盐酸的量(选填“>”,“=”或“<”) 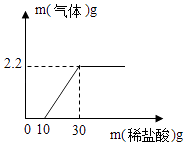
【答案】
(1)可能有
(2)碳酸钠和氯化钠
(3)解:由于2.2g二氧化碳是20g盐酸和碳酸钠反应所得.
设参加反应的HCl的质量为x
Na2CO3+ | 2HCl= | 2NaCl+H2O+ | CO2↑ |
73 | 44 | ||
x | 2.2g |
![]() =
= ![]()
x=3.65g
稀盐酸的质量分数为 ![]() ×100%=18.25%
×100%=18.25%
答:稀盐酸的质量分数为18.25%
(4)=
【解析】解:(1)氢氧化钠变质会生成碳酸钠,氢氧化钠和碳酸钠溶液都是显碱性的,无法用酚酞确定是否有氢氧化钠;(2)当加入10g盐酸是,此时开始有二氧化碳气体生成,说明溶液中有碳酸钠,同时还有氢氧化钠和盐酸反应生成的氯化钠;(4)由于钠元素和氯元素守恒,所以变质前后消耗的HCl的质量相等,也就是导致消耗的盐酸的质量相等.
所以答案是:(1)可能有;(2)碳酸钠和氯化钠;(3)18.25%;(4)=.
【考点精析】解答此题的关键在于理解根据化学反应方程式的计算的相关知识,掌握各物质间质量比=系数×相对分子质量之比.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目