题目内容
29.(2010?崇文区二模)(1)化学小组同学用下列仪器和试剂,验证金属与盐酸反应速率的影响因素.实验仪器:烧杯、石棉网、酒精灯、铁架台(带铁圈)、镊子、量筒、天平等.
实验试剂:锌片、铁片、镁片.溶质质量分数分别为5%、20%的盐酸.
①不同金属与酸反应的快慢不同取质量相等的镁、锌、铁中两种金属,分别放入溶质质量分数相同的足量稀盐酸中,生成氢气的质量(m)与反应时间(t)的关系曲线如图所示.则线B对应的金属为,线A对应的金属与稀盐酸反应的化学方程式为.

②同种金属与不同溶质质量分数的盐酸反应的快慢不同取两份质量相等的锌片,分别放入5%和20%的足量
稀盐酸中,生成氢气的质量为m,反应时间为t.对比5%和20%的稀盐酸分别与锌片反应情况,下列关系曲线正确的是(填字母序号).
A.
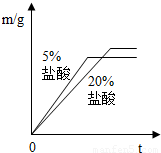 B.
B.
C.
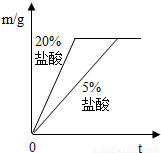 D.
D.
实验表明,盐酸中溶质的质量分数越大,与金属反应的速率越快.
③温度对金属与盐酸反应速率也有影响,且实验表明,温度越高,盐酸与金属反应的速率越快.请用控制变量的方法设计实验,验证以上结论,实验方案为.
(2)同学们做完实验后,将含有CuCl2、ZnCl2、FeCl2的废液倒在废液缸里,如果将废液直接排放,就会造成水污染.于是几位同学利用课余时间处理废液,回收工业重要原料氯化锌和有关金属.实验过程如下图所示.

请回答:
①滤液A和滤液B含有的一种相同溶质的化学式是;
②写出步骤①反应的化学方程式;
③检验步骤④中加入的稀盐酸是否过量的方法是.
【答案】分析:(1)①可从反应速率和氢气生成量两的方面来判断,镁、锌的反应速率要比铁快,由关系式计算可知m克铁生成m/28克氢气,m克锌可生成m/32克氢气,m克镁可生成m/12克氢气,镁反应最快生成氢气最多;锌反应比铁快生成氢气最少;铁反反应最慢生成氢气量居中.
②反应物种类相同时反应物浓度高反应速率快,20%的盐酸比5%的盐酸反应速率快.
③可设计反应物相同,一个加热,一个不加热的实验来比较反应速率.
(2)CuCl2、ZnCl2、FeCl2混合物与锌粉反应生成Cu、Fe和ZnCl2溶液,经过滤磁铁吸附可把铁,铜和氯化亚铁溶液分开.
解答:解:(1)①镁、锌的反应速率要比铁快,并且由化学方程式Fe+2HCl═FeCl2+H2↑ Zn+2HCl═ZnCl2+H2↑ Mg+2HCl═MgCl2+H2↑可知m克铁生成m/28克氢气,m克锌可生成m/32克氢气,m克镁可生成m/12克氢气.图中B线反应快生成氢气少,可知对应的金属为锌;A线反应速率比锌慢可知为铁故答案为:Zn、Fe+2HCl═FeCl2+H2↑
②反应物种类相同时反应物浓度高反应速率快,20%的盐酸比5%的盐酸反应速率快,可排除A、D;取质量相同的锌片生成的氢气质量相同故排除B,因此答案为C
③可设计反应物相同,一个加热,一个不加热的实验来比较反应速率,故答案为:取两份质量相等的铁片,分别放入盛有5%的足量稀盐酸的烧杯中,将其中一只烧杯里溶液加热,观察两只烧杯中产生气泡的快慢.
(2)①CuCl2、ZnCl2、FeCl2混合物与锌粉反应生成Cu、Fe和ZnCl2溶液,经过滤,把铜、铁和锌固体与ZnCl2溶液分开,滤液A为 ZnCl2溶液,磁铁吸附可把铁和铜、锌分开,因为步骤④后生成了铜,所以D为铜和乘余的锌粉,固体C为铁,锌粉与过量稀盐酸反应生成ZnCl2溶液故答案为:ZnCl2
②通过对①的分析可知答案为:Zn+CuCl2═ZnCl2+Cu、Zn+FeCl2═ZnCl2+Fe
③如果步骤④中盐酸不过量那么仍有锌粉存在,与浅绿色的FeCl2溶液反应溶液退色,如果盐酸过量则溶液不退色.故答案为:Zn+FeCl2═Fe+ZnCl2
点评:该题通过锌、铁、镁与盐酸之间的反应考查了反应速率的知识点,并通过回收有用原料增加了学生节约药品和爱护环境的意识.
②反应物种类相同时反应物浓度高反应速率快,20%的盐酸比5%的盐酸反应速率快.
③可设计反应物相同,一个加热,一个不加热的实验来比较反应速率.
(2)CuCl2、ZnCl2、FeCl2混合物与锌粉反应生成Cu、Fe和ZnCl2溶液,经过滤磁铁吸附可把铁,铜和氯化亚铁溶液分开.
解答:解:(1)①镁、锌的反应速率要比铁快,并且由化学方程式Fe+2HCl═FeCl2+H2↑ Zn+2HCl═ZnCl2+H2↑ Mg+2HCl═MgCl2+H2↑可知m克铁生成m/28克氢气,m克锌可生成m/32克氢气,m克镁可生成m/12克氢气.图中B线反应快生成氢气少,可知对应的金属为锌;A线反应速率比锌慢可知为铁故答案为:Zn、Fe+2HCl═FeCl2+H2↑
②反应物种类相同时反应物浓度高反应速率快,20%的盐酸比5%的盐酸反应速率快,可排除A、D;取质量相同的锌片生成的氢气质量相同故排除B,因此答案为C
③可设计反应物相同,一个加热,一个不加热的实验来比较反应速率,故答案为:取两份质量相等的铁片,分别放入盛有5%的足量稀盐酸的烧杯中,将其中一只烧杯里溶液加热,观察两只烧杯中产生气泡的快慢.
(2)①CuCl2、ZnCl2、FeCl2混合物与锌粉反应生成Cu、Fe和ZnCl2溶液,经过滤,把铜、铁和锌固体与ZnCl2溶液分开,滤液A为 ZnCl2溶液,磁铁吸附可把铁和铜、锌分开,因为步骤④后生成了铜,所以D为铜和乘余的锌粉,固体C为铁,锌粉与过量稀盐酸反应生成ZnCl2溶液故答案为:ZnCl2
②通过对①的分析可知答案为:Zn+CuCl2═ZnCl2+Cu、Zn+FeCl2═ZnCl2+Fe
③如果步骤④中盐酸不过量那么仍有锌粉存在,与浅绿色的FeCl2溶液反应溶液退色,如果盐酸过量则溶液不退色.故答案为:Zn+FeCl2═Fe+ZnCl2
点评:该题通过锌、铁、镁与盐酸之间的反应考查了反应速率的知识点,并通过回收有用原料增加了学生节约药品和爱护环境的意识.

练习册系列答案
相关题目
(2010?崇文区二模)为研究某镁铝合金的成分,进行甲、乙、丙三组实验.三组各取30g溶质质量分数相同的盐酸溶液,加入该种镁铝合金粉末.每组实验加入合金质量和产生气体质量的有关数据如下:
根据表中的数据可判断( )
| 实验序号 | 甲 | 乙 | 丙 |
| 合金质量(g) | 0.153 | 0.255 | 0.385 |
| 气体质量(g) | 0.015 | 0.025 | 0.03 |