题目内容
2018年2月9日,歼﹣20开始列装空军作战部队。它是一款具备高隐身性、高态势感知、高机动性的隐形第五代战斗机。其隐身材料是目前最新的纳米高分子复合材料。芳纶是一种可做此材料的新型高科技特种纤维,可由间苯二甲酰氯和间苯二胺缩聚而成。其中,间苯二胺的化学式是C6H8N2,试回答:

①间苯二胺属于_____(填写“单质”“氧化物”“有机物”)之一。
②间苯二胺由_____种元素组成。
③间苯二胺分子中,N、H两种原子的个数之比为_____(填最简整数比)。
④间苯二胺中,碳元素和氢元素的质量之比为_____(填最简整数比)。
⑤间苯二胺中,所含元素质量分数最大的元素是_____。
 阅读快车系列答案
阅读快车系列答案人类发展的历史进程中人们不断研制出各种不同的用具,制造用具的材料也在不断地发生变化,金属制品因其美观、耐用、轻便易成型而被人们广泛利用,请根据所学知识及生活知识参与有关金属制品探究。
(一)以下工具的制作过程中没有发生化学变化的是_____。
A原始人制作石刀 B冶炼青铜 C炼铁
(二)请将以下金属材料的冶炼按年代的先后顺序排序_____(填序号)。
A铁 B青铜 C铝
从以上顺序可以看出,金属制品的出现顺序与_____有关,那么金属钾的制得应排在_____(填序号)之后。
(三)铜器是生活中常见物品,铜器保存不善,表面会生成一层绿色铜锈Cu2(OH) 2CO3.铜生锈的条件除了水和氧气外还需要_____(写化学式)。
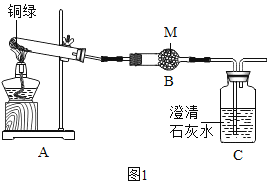
(四)为了探究碱式碳酸铜的化学性质和组成,该小组同学取少量铜绿(假设杂质不参与反应)按如图装置进行实验:
已知:I.铜绿的主要成分是碱式碳酸铜。
Ⅱ.铜器因所处环境不同,生成的铜绿中可能还含有CuSO4和CuCl2。
Ⅲ.硫酸铜、氯化铜的化学性质稳定,酒精灯加热条件下不分解。
(1)M药品的名称是_____。
(2)写出Cu2(OH)2CO3分解的化学方程式_____。
(3)实验过程中,发现A中绿色固体逐渐变为黑色,B中固体变蓝色,C中现象为_____,此处发生反应的化学方程式为_____。
(4)为了验证铜绿中是否有CuSO4和CuCl2,该小组同学进行了如下实验,请补充完成下列实验报告:
步骤 | 操作 | 现象及结论 |
① | 取少量铜绿溶于足量稀硝酸中,并将溶液分成甲、乙两份 | 产生气泡 |
② | 向甲中滴加硝酸钡溶液 | 若观察到_____,则铜绿中含有CuSO4 |
③ | 向乙中加入过量的硝酸钡溶液,振荡、静置,取上层清液于试管中,再滴加_____。 | 若观察到产生白色沉淀,则铜绿中含有CuCl2 |
(五)已知:
①铜矿矿石中含有Cu2(OH)2CO3及含铁元素的杂质;
②黄铵铁矾的化学式为 (NH4)xFey(SO4)m(OH)n,其中铁为+3价。
③在化学中Fe3O4可以表示为FeO•Fe2O3
某兴趣小组利用该铜矿石制黄铵铁矾的流程如图2:
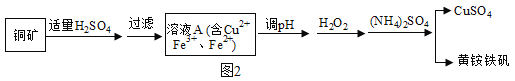
(1)以氧化物的形式表示Cu2(OH)2CO3的组成为_____,111gCu2 (OH)2CO3与稀H2SO4反应时消耗H2SO4的质量为_____g。
(2)该小组为测定黄铵铁矾的组成,进行了如下实验:
a.称取mg样品,加盐酸完全溶解后,将所得溶液分为两等份;
b.向一份中加入足量NaOH溶液并加热,收集到0.0425g的气体(假设气体全部逸出)。将所得沉淀过滤、洗涤、灼烧至恒重,得到红棕色粉末0.600g。
c.向另一份中加足量BaCl2溶液充分反应后,过滤、洗涤、干燥得沉淀1.165g。
①黄铵铁矾中NH4+与SO42﹣的个数比为_____。
②通过计算确定黄铵铁矾的化学式_____。(写出计算过程)
无色液体X是下列四种物质中的一种。将其分成等量的三份,向其中分别加入少量的稀硫酸、饱和石灰水、酚酞试液,产生的现象如下表。则X是下列选项中的( )
加入的物质 | 稀硫酸 | 饱和石灰水 | 酚酞试液 |
现象 | 有气泡冒出 | 有白色沉淀 | 变成红色 |
A. 稀盐酸 B. NaOH溶液 C. NaCl溶液 D. Na2CO3溶液


 3Ba↑+Ba(AlO2)2.下列说法正确的是( )
3Ba↑+Ba(AlO2)2.下列说法正确的是( )