题目内容
【题目】(8分)钓鱼岛及其附属海域是我国固有领土,蕴藏着丰富的海洋资源。
(1)海水制盐。从海水制取的粗盐中含有泥沙、硫酸镁和氯化钙等杂质,为得到较纯的氯化钠,将粗盐溶于水,然后进行如下操作:a.加过量的Ba(OH)2溶液;b.加适量的盐酸;c.加过量的Na2CO3溶液;d.过滤;e.蒸发。正确的操作顺序是___________(填字母)。加Na2CO3溶液的作用是除去________。
用提纯的NaCl配制200g0.9%的生理盐水,需要NaCl的质量为 g。
①配制该溶液时所需要的玻璃仪器有:
②如果配制后溶液溶质的质量分数低于0. 9%,你认为可能的原因是 (写一个即可)
(2)海水制镁。从海水中提取金属镁的过程如下图所示:
![]()
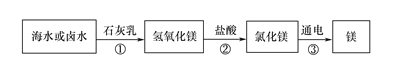
在上述转化过程中发生中和反应的方程式是 ________________ 。海水中本身就含有氯化镁,则①、②两步的作用是_______________
(3)海水“制碱”。氨碱法制纯碱中生成NaHCO3和NH4Cl的化学方程式为 _____
【答案】(1)a c d b e 除氯化钙和过量的氢氧化钡 1.8
①量筒、胶头滴管、烧杯、玻璃棒 ②读数时采用仰视读数或氯化钠中有杂质
(2)Mg(OH)2+2HCl==MgCl2+2H2O 使镁离子富集
(3)NH3+CO2+NaCl+H20=NaHCO3+NH4Cl
【解析】
试题分析:(1)加过量的Ba(OH)2溶液是除去硫酸镁杂质,而加过量的Na2CO3溶液除氯化钙和过量的氢氧化钡,故c一定要放在a之后,故正确的操作顺序是a c d b e ;加Na2CO3溶液的作用是除去:除氯化钙和过量的氢氧化钡;根据溶质质量分数的表达式,配制200g0.9%的生理盐水,需要NaCl的质量=200g ×0.9%=1.8g
①配制溶液的步骤:计算、称量、量取、溶解,故所需要的玻璃仪器有:量筒、胶头滴管、烧杯、玻璃棒
②如果配制后溶液溶质的质量分数低于0. 9%,根据溶质质量分数的表达式,要不是溶质质量偏小,要不就是溶剂质量偏大,故可能的原因是:读数时采用仰视读数或氯化钠中有杂质等
(2)中和反应是酸和碱作用生成盐和水的反应,故化学反应方程式是:Mg(OH)2+2HCl==MgCl2+2H2O; 海水中本身就含有氯化镁,则①、②两步的作用是:使镁离子富集
(3)氨碱法制纯碱,是将氨气、二氧化碳通入到饱和的食盐水中生成NaHCO3和NH4Cl,反应的化学方程式为:NH3+CO2+NaCl+H20=NaHCO3+NH4Cl

【题目】(7分)春节期间,小颖你妈妈去医院打点滴,发现护士往输液管上放了一个纸包,经询问得知它是输液恒温贴。可以温暖输入人体中的液体。小颖对包里的东西能产生热量感到很奇,于是,他向护士要了一只输液恒温贴,带回来进行了如下探究。

撕开真空包装封口,解开内衣包装袋,倒出其中的粉末,发现成黑色。
【提出问题】黑色粉末可能含有哪些物质呢?
【猜想与假设】该黑色粉末可能含有碳粉、铁粉、二氧化锰、氧化铜、四氧化三铁中的一种或几种。
【初步认证】将磁铁靠近黑色粉末,部分被吸引。
【查阅资料】四氧化三铁能被磁铁吸引。四氧化三铁与盐酸反应生成氯化亚铁,氯化铁和水
【初步结论】黑色粉末可能含有 。
【进行实验】
实验编号 | 实验操作 | 实验现象 |
① | 取少量黑色粉末于试管中,加足量稀硫酸 | 固体部分溶解,有气泡产生,溶液变为浅绿色, |
② | 将实验①试管中的物质过滤,向滤液中加入足量铁粉 | 有气泡产生,无红色物质析出 |
③ | 取实验②滤渣灼烧,将内壁涂有澄清石灰水的小烧杯罩在上方 | 澄清石灰水变浑浊 |
由上述实验可知,该黑色粉末肯定含有 ,肯定不含 ;写出实验①中产生气体的化学方程式 .
【交流讨论】
①输液恒温贴真空包装的原因:铁粉在空气中会与 发生缓慢氧化转化成铁锈
并放出热量。
②输液恒温贴中炭粉的作用是 。