��Ŀ����
����Ŀ���������岿��ʧˮ��õ�ij����ͭ���壨CuSO4xH2O������ѩͬѧΪ�о�CuSO4xH2O���Ⱥ��������ʵ���ɣ���������ʵ�飺ȡ10.7gCuSO4xH2O�������ʹ��ֽ⣬���Ƴ�������������¶ȵı仯��ϵͼ����ͼ��ʾ����t1��ʱ�ù�����ȫʧȥ�ᾧˮ����ѧ����ʽΪ��CuSO4xH2O ![]() CuSO4+xH2O���� �ش��������⣮��д��������̣�
CuSO4+xH2O���� �ش��������⣮��д��������̣�
��1��CuSO4��ͭԪ�ص����������Ƕ��٣�
��2�����������ͭ���壨CuSO4xH2O����x��ֵ��
��3�����µ�t2�棬���������Ǻ�ɫ���ʣ���m��ֵ��
���𰸡�
��1���⣺CuSO4��ͭԪ�ص����������� ![]() ��100%=40%��
��100%=40%��
��CuSO4��ͭԪ�ص�����������40%
��2���⣺����CuSO4xH2O ![]() CuSO4+xH2O����CuSO4
CuSO4+xH2O����CuSO4 ![]() CuO+SO3���ɵù�ϵΪCuSO4������xH2O��������CuO
CuO+SO3���ɵù�ϵΪCuSO4������xH2O��������CuO
���ڼ��ȵ�t1��ʱ�ù�����ȫʧȥ�ᾧˮ����8.0gΪ����ͭ��ˮ������Ϊ10.7g��8.0g=2.7g
CuSO4������ | xH2O�������� | CuO |
160 | 18x | 80 |
8.0g | 2.7g | m |
![]() =
= ![]() =
= ![]()
x=3
m=4g
�𣺸�����ͭ���壨CuSO4xH2O����x��ֵΪ3
��3���⣺����CuSO4xH2O ![]() CuSO4+xH2O����CuSO4
CuSO4+xH2O����CuSO4 ![]() CuO+SO3���ɵù�ϵΪCuSO4������xH2O��������CuO
CuO+SO3���ɵù�ϵΪCuSO4������xH2O��������CuO
���ڼ��ȵ�t1��ʱ�ù�����ȫʧȥ�ᾧˮ����8.0gΪ����ͭ��ˮ������Ϊ10.7g��8.0g=2.7g
CuSO4������ | xH2O�������� | CuO |
160 | 18x | 80 |
8.0g | 2.7g | m |
![]() =
= ![]() =
= ![]()
x=3
m=4g
�����µ�t2�棬���������Ǻ�ɫ���ʣ�mΪ4g
����������1������CuSO4�л�ѧʽ����ͭԪ�ص�������������2������ʣ������������������ϻ�ѧ����ʽ����x��ֵ����3�����µ�t2�棬���������Ǻ�ɫ����Ϊ����ͭ������ͭԪ���غ���m��ֵ��
�����㾫����������Ĺؼ�����������ݻ�ѧ��Ӧ����ʽ�ļ�������֪ʶ�����ո����ʼ�������=ϵ������Է�������֮�ȣ�

����Ŀ���±���ij���г������۵�һ�֡��ӵ��Ρ���װ���ϵIJ�������˵��������ݴ˱�����ϳ���ѧ���Ļ�ѧ֪ʶ���ش��������⣺
���ϱ� | ���ƺ��Ρ�����أ�KIO3�� |
������ | 20��40mg/Kg |
���ط��� | �ܷ�ܹ⡢���� |
ʳ�÷��� | ���ʱ��ʳƷ��������� |
��1������������������ʣ��������������������������ʡ��������������
��2�����ݺ����ε�ʳ�÷��������Ʋ����صĻ�ѧ���ʣ������������ʱ
��3���ҹ��涨��ʳ�κ�����Ϊÿǧ��ʳ�κ���0.035�ˣ��൱��ÿǧ��ʳ�κ�����ض��ٿˣ�
����Ŀ��С��Ϊ��̽���¶ȶ�H2O2�ֽⷴӦ���ʵ�Ӱ�죬������ͼ��ʾʵ��װ�ã��г�װ����ȥ��������������ʵ�飬����ʵ��IJ�����������ʾ�� 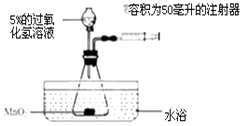
ʵ��1 | ʵ��2 | |
MnO2������/�� | 0.5 | 0.5 |
5%��H2O2�����/���� | 40 | ���� |
ˮԡ�¶�/�� | 20 | 80 |
��1��ʵ��2��Ӧ����5%H2O2������
��2��������ʵ���У���ͨ���۲����Ƚ�H2O2�ֽⷴӦ���ʵĴ�С��
��3��ʵ��2��ˮԡ�¶ȿ�����80��ʱ���ⶨ�ķ�Ӧ���ʻ����ʵֵƫ����ԭ�����ƿ���������������⣬������
��4��ʵ���������Ҫ��MnO2�ӻ�����з���������ɲ�ȡ��ʵ�����������1��2ϴ�ӡ�3���