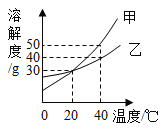
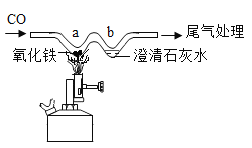
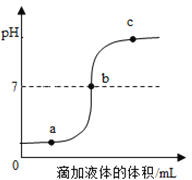
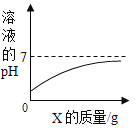
题目内容
【题目】实验室常用大理石和稀盐酸制取二氧化碳。现取25g含碳酸钙的大理石于烧杯中,缓慢加入稀盐酸(大理石中的杂质不溶于水,也不与稀盐酸反应),剩余固体质量与加入稀盐酸的质量关系如下图。求:
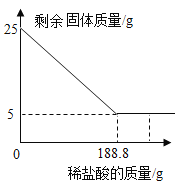
(1)25g大理石中碳酸钙的质量分数为_____________:
(2)恰好完全反应时所得溶液中溶质的质量分数___________(写出计算步骤)。
【答案】80% 11.1%(详见解析)
【解析】
(1)25g大理石中碳酸钙的质量分数为:![]() =80%;
=80%;
(2)恰好完全反应时所得溶液中溶质的质量为x,生成二氧化碳的质量为y
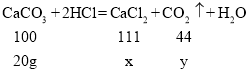
![]()
![]()
x=22.2g y=8.8g
恰好完全反应时所得溶液中溶质的质量分数:
![]()
答:恰好完全反应时所得溶液中溶质的质量分数为:11.1%

【题目】小红和小明在学完酸的化学性质之后,做了如下图1的①—⑤的实验,根据图1,回答下列问题:
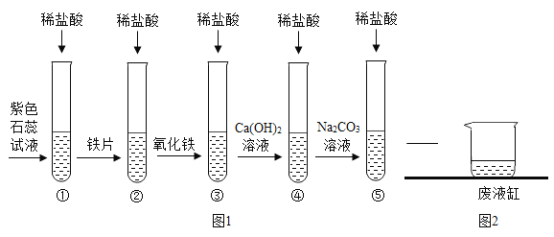
(1)图1中五个实验验证了酸的化学性质,其中反应后实验②中一定含有的阳离子是_____,实验③发生反应的化学方程式是_____。
(2)实验④在反应时没有明显的实验现象,为了确定实验④反应的发生,可以在Ca(OH)2溶液中加入试剂_____,发生的现象是_____。
(3)实验结束后,小红一次将实验④和实验⑤的废液缓缓倒入同一洁净的废液缸中(如上图2),观察到废液缸内先有气泡产生,后有白色沉淀产生。通过废液缸中出现现象,可以判断实验④废液中含有的溶质是_____。
(4)小红将废液缸中的物质进行过滤,得到白色沉淀和无色溶液,欲探究无色滤液中溶质的成分。
(提出问题)过滤出的无色滤液中含有什么溶质?
(作出猜想)①NaCl②NaCl和CaCl2③NaCl和Na2CO3④NaCl、CaCl2和Na2CO3
小明认为猜想_____一定不正确。
(进行实验)
实验步骤 | 实验现象 | 实验结论 |
小红取少量滤液于试管中,滴加少量碳酸钠溶液 | 无明显现象 | 猜想②不成立 |
小红取少量滤液于试管中,滴加少量_____溶液。 | 有白色沉淀生成 | 猜想_____成立 |
(表达与交流)两位同学确认了最终废液中溶质的成分,你认为处理该废液的方法是_____。