题目内容
加热8g高锰酸钾一段时间后,称得剩余固体的质量是7.4g,那么剩余物是
- A.MnO2 K2MnO4
- B.K2MnO4
- C.KMnO4 K2MnO4
- D.MnO2 KMnO4 K2MnO4
D
分析:根据高锰酸钾在受热后会放出氧气,固体质量减少量即为生成氧气的质量.;所以根据化学反应方程式由氧气的质量可以计算出参与反应的高锰酸钾的质量,从而得到剩余物的成分.
解答:根据质量守恒定律,固体减少的质量是氧气的质量,所以氧气质量为:8g-7.4g=0.6g,
生成0.6g的氧气需要分解高锰酸钾的质量为x,
2KMnO4 K2MnO4+MnO2+O2↑
K2MnO4+MnO2+O2↑
316 32
x 0.6g
则 =
=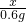 ,
,
解得,x=5.925g,
所以反应后高锰酸钾没有分解完,还生成了锰酸钾和二氧化锰,
故选D.
点评:在解此类题时,首先分析反应原理,然后通过方程式计算出物质的质量,结合题中的数据进行具体的分析.
分析:根据高锰酸钾在受热后会放出氧气,固体质量减少量即为生成氧气的质量.;所以根据化学反应方程式由氧气的质量可以计算出参与反应的高锰酸钾的质量,从而得到剩余物的成分.
解答:根据质量守恒定律,固体减少的质量是氧气的质量,所以氧气质量为:8g-7.4g=0.6g,
生成0.6g的氧气需要分解高锰酸钾的质量为x,
2KMnO4
 K2MnO4+MnO2+O2↑
K2MnO4+MnO2+O2↑316 32
x 0.6g
则
 =
=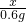 ,
,解得,x=5.925g,
所以反应后高锰酸钾没有分解完,还生成了锰酸钾和二氧化锰,
故选D.
点评:在解此类题时,首先分析反应原理,然后通过方程式计算出物质的质量,结合题中的数据进行具体的分析.

练习册系列答案
相关题目