题目内容
【题目】尿素是一种常用氮肥,其化学式为CO(NH2)2。
(1)尿素由________种元素组成。
(2)尿素中C、H两种元素的质量比为________。
(3)尿素的相对分子质量为________。
(4)尿素中碳元素的质量分数为________。
(5)肖林家中有一块稻田,需施15Kg尿素,他到农资公司购买,由于尿素售完,他需购硝酸铵(NH4NO3)代替尿素,他应购的硝酸铵的质量为_________Kg。(要计算过程)
【答案】四 3:1 60 20% 20
【解析】
(1)尿素是由碳、氧、氮、氢四种元素组成的.
(2)尿素中碳、氢元素的质量比为12:(1×2×2)=3:1.
(3)尿素的相对分子质量为12+16+(14+1×2)×2=60.
(4)尿素中氮元素的质量分数为:![]() ×100%=20%.
×100%=20%.
(5)设应购的硝酸铵的质量为x,
15Kg×![]() ×100%=x×
×100%=x×![]() ×100%
×100%
x=20kg.
故答案为:(1)四;(2)3:1;(3)60;(4)20%;(5)20。

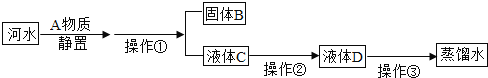
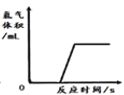
【题目】某兴趣小组同学对实验室制备氧气的条件进行如下探究实验.
(提出问题)
①氧化铜是否也能作氯酸钾分解的催化剂?②它是否比二氧化锰催化效果更好?
(设计并完成实验)
Ⅰ.将3.0g氯酸钾放在试管中加热
Ⅱ.将3.0g氯酸钾与1.0g二氧化锰均匀混合加热
Ⅲ.将x g氯酸钾与1.0g氧化铜均匀混合加热
(实验现象分析)
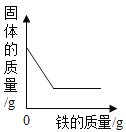
Ⅲ中x的值应为_____;将实验Ⅰ和Ⅲ比较可证明_____;将实验Ⅲ反应后的固体加水溶解、过滤、洗涤、干燥,若称量得到1.0g黑色粉末,再将黑色粉末和xg氯酸钾混合加热,现象与实验Ⅲ相同,此步骤是为了证明氧化铜在该化学反应前后_____和_____都不变.
(结论)氧化铜还能作氯酸钾分解的催化剂。
(实验反思)实验Ⅱ和Ⅲ对比是为了证明_____。
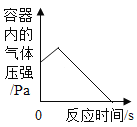
(提出问题)②双氧水分解速度还和什么因素有关
(设计并完成实验)
双氧水的质量 | 双氧水的浓度 | MnO2的质量 | 相同时间内产生产生O2体积 | |
Ⅰ | 50.0g | 1% | 0.1g | 9mL |
Ⅱ | 50.0g | 2% | 0.1g | 16mL |
Ⅲ | 50.0g | 4% | 0.1g | 31mL |
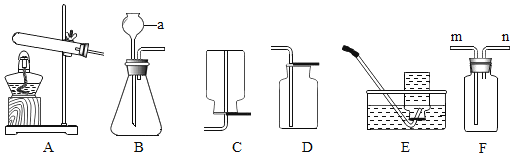
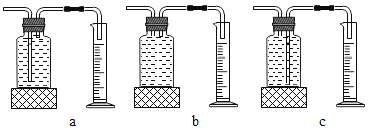
本实验中,测量O2体积的装置是_____(填编号)
(结论)在相同条件下,双氧水的浓度越大,双氧水分解得越_____。