题目内容
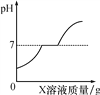
【题目】向盐酸和CaCl2的混合溶液中逐滴滴入X的溶液,所得溶液的pH随滴入溶液质量的变化关系如图所示。则X可能是( )
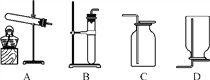
A. H2O B. HCl
C. Na2CO3 D. Ca(OH)2
【答案】C
【解析】A、向盐酸和CaCl2的混合溶液中逐滴滴入水,溶液始终呈酸性,pH不会等于或大于7,不符合题意;B、向盐酸和CaCl2的混合溶液中逐滴滴入盐酸,溶液始终呈酸性,pH不会等于或大于7,不符合题意;C. 向盐酸和CaCl2的混合溶液中逐滴滴入碳酸钠溶液,先与盐酸反应生成氯化钠和水,刚好完全反应时,溶质为氯化钠、氯化钙,呈中性,pH=7;继续加入碳酸钠过量,和氯化钙反应生成碳酸钙沉淀和氯化钠,溶液呈中性,pH=7;再继续加入,碳酸钠过量,溶质是碳酸钠和氯化钠,溶液呈碱性,pH大于7,符合题意;D、向盐酸和CaCl2的混合溶液中逐滴滴入氢氧化钙溶液,和盐酸反应生成氯化钙和水,溶质只有氯化钙,溶液呈中性,氢氧化钙过量后,溶质为氢氧化钙和氯化钙呈碱性,溶液的pH立即大于7,不符合题意;故选C

【题目】某研究小组为探究“影响铁制品锈蚀快慢的因素”,取同浓度的稀氨水和稀醋酸,用右图装置完成表中实验,回答下列问题。
![]()
实验序号 | ① | ② | ③ | ④ |
实验温度/℃ | 25 | 25 | 70 | 70 |
试剂 | 稀氨水 | 稀醋酸 | 稀氨水 | 稀醋酸 |
出现铁锈 所需时间 | 1天 未见锈蚀 | 5分钟 | 1天 未见锈蚀 | 1分钟 |
(1)铁锈的主要成分是________(填化学式)。
(2)实验②和④可探究________因素对铁制品锈蚀快慢的影响;欲探究试剂酸碱性对铁制品锈蚀快慢的影响,应选择的实验是______________(填实验序号)。
(3)根据表中实验现象得出的结论是_________________(写出1点即可)。
(4)影响铁制品的锈蚀快慢除上述因素外,还有______________________(写出1点即可),请设计实验方案_________________________________________________。
【题目】从分子的角度分析并解释下列事实,不正确的是
A | 碘酒是混合物 | 由不同种分子构成 |
B | 丹桂飘香 | 分子在不断运动着 |
C | 气体受热膨胀 | 温度升高,分子自身体积增大 |
D | 固体碘受热升华 | 碘分子间的间隔变大 |
A. A B. B C. C D. D