题目内容
质量相等的金属镁和铝分别加入质量相等、溶质质量分数相等的两份稀硫酸中,反应完毕后,金属均有剩余.则反应两种溶液质量关系是
- A.相等
- B.镁反应后的溶液质量大
- C.铝产生的气体质量大
- D.无法比较
B
分析:在金属活动性顺序中,镁和铝都排在氢的前面,可以置换出酸中的氢,生成氢气.
解答:将质量相等的金属镁和铝分别加入质量相等、溶质的质量分数相等的两份稀硫酸中,反应完毕后,金属均有剩余,说明硫酸全部参加反应,硫酸的量相等,故所含的氢相等,所以生成氢气的质量相同.(这里我用常规方法解读)
设生成的氢气质量都为a,镁对应的硫酸镁的质量为x,铝对应的硫酸铝的质量为y.
H2~MgSO4
2 120
a x
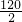 =
= x=60a
x=60a
3H2~Al2(SO4)3
6 342
a y
 =
=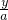 y=57a
y=57a
所以镁对应的溶质多.
故选B.
点评:计算金属与酸反应生成氢气的质量分为两种情况,一是金属全部参加反应,一是酸全部参加反应,计算时要具体情况具体分析.本题不是计算氢气的质量,而是溶质的质量.
分析:在金属活动性顺序中,镁和铝都排在氢的前面,可以置换出酸中的氢,生成氢气.
解答:将质量相等的金属镁和铝分别加入质量相等、溶质的质量分数相等的两份稀硫酸中,反应完毕后,金属均有剩余,说明硫酸全部参加反应,硫酸的量相等,故所含的氢相等,所以生成氢气的质量相同.(这里我用常规方法解读)
设生成的氢气质量都为a,镁对应的硫酸镁的质量为x,铝对应的硫酸铝的质量为y.
H2~MgSO4
2 120
a x
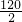 =
= x=60a
x=60a3H2~Al2(SO4)3
6 342
a y
 =
=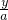 y=57a
y=57a所以镁对应的溶质多.
故选B.
点评:计算金属与酸反应生成氢气的质量分为两种情况,一是金属全部参加反应,一是酸全部参加反应,计算时要具体情况具体分析.本题不是计算氢气的质量,而是溶质的质量.

练习册系列答案
相关题目