题目内容
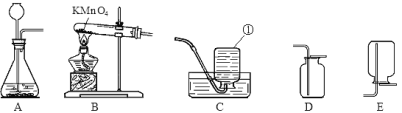
【题目】(9分)根据下图装置,回答下列有关问题:
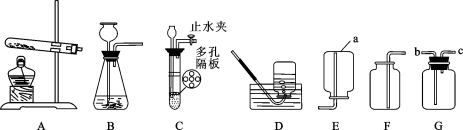
(1)装置图中仪器a的名称为 。
(2)采用加热氯酸钾和二氧化锰的混合物制取氧气时,反应的文字表达式 ,可选用的发生装置是 。若收集较纯的氧气,可选用的收集装置是 ,当 证明氧气已经收集满。
(3)选用E装置收集氢气的原因是 ;若用G装置采用排空法收集氢气,氢气应从 进。(选“b”或“c”)
(4)实验室利用上述发生装置制备氧气,其原理对环境较友好的化学反应文字表达式是 。
(5)实验室在用某紫黑色固体制取氧气时,若用装置A作为气体发生装置,则要在装置A中再加 。
【答案】(1)集气瓶
(2)氯酸钾![]() 氯化钾+氧气
氯化钾+氧气
A D 瓶口有气泡冒出
(3)氢气的密度比空气小(且不与空气反应) c
(4)过氧化氢![]() 水 + 氧气
水 + 氧气
(5)一团棉花
【解析】
试题分析:(1)装置图中仪器a的名称为:集气瓶。
(2)加热氯酸钾和二氧化锰的混合物制取氧气时,二氧化锰作催化剂,生成氯酸钾和氧气,故反应的文字表达式为:氯酸钾![]() 氯化钾+氧气;根据反应物的状态——固态,及反应条件——加热,可知应选用固固加热装置,故选A;氧气密度比空气大且不易溶于水,故可用向上排空气法或排水法收集,但是用排空气法收集,收集到的气体中易混有空气,不纯净,排水法可收集到较纯净的氧气,故选D;当瓶口有较大气泡冒出时证明氧气已集满。
氯化钾+氧气;根据反应物的状态——固态,及反应条件——加热,可知应选用固固加热装置,故选A;氧气密度比空气大且不易溶于水,故可用向上排空气法或排水法收集,但是用排空气法收集,收集到的气体中易混有空气,不纯净,排水法可收集到较纯净的氧气,故选D;当瓶口有较大气泡冒出时证明氧气已集满。
(3)E装置表示的是向下排空气法,用此装置收集氢气是因为氢气的密度比空气小(且不与空气反应);由于氢气密度比空气小,故若用G装置收集氢气,氢气应c管进入,空气从b管排出。
(4)对环境较友好,即对空气污染小的,实验室中制取氢气污染小的是过氧化氢分解,反应的文字表达式为:过氧化氢![]() 水 + 氧气。
水 + 氧气。
(5)实验室中制取氧气的紫黑色固体是高锰酸钾,加热高锰酸钾制氧气时,试管口应加一团棉花。

 期末1卷素质教育评估卷系列答案
期末1卷素质教育评估卷系列答案【题目】(10分)北塘化学兴趣小组同学对实验室制备氧气的若干问题进行如下实验探究。
(一)为探究催化剂的种类对氯酸钾分解速度的影响,A小组设计了以下对比实验:
a.将12.25g KClO3与5.0g MnO2均匀混合加热
b.将12.25g KClO3与5.0g CuO均匀混合加热
(1)在相同温度下,比较两组实验产生O2的快慢。通常采用的方法有:
①测相同时间内产生O2的体积;②测 。
(2)试计算:12.25g KClO3中所含氧元素质量与多少克过氧化氢中所含氧元素的质量相等?(请写出计算过程)。
(二)为探究影响双氧水分解速度的某种因素,B小组记录了如下实验数据:
双氧水的质量 | 双氧水的浓度 | MnO2的质量 | 相同时间内产生O2的体积 | |
I | 50.0g | 1% | 0.1g | 9mL |
II | 50.0g | 2% | 0.1g | 16mL |
III | 50.0g | 4% | 0.1g | 31mL |
【数据处理及结论】
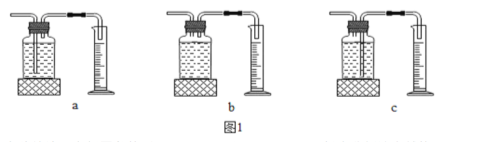
(3)本实验中,测量O2体积的装置是 (选填下图1中的装置编号)。
(4)实验结论:在相同条件下, ,双氧水分解速率越快。
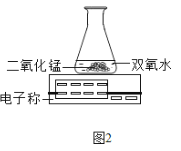
(5)C小组用如图2装置进行实验,通过比较 也能达到实验目的。
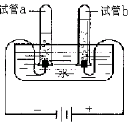
(三)D小组在加热二氧化锰样品时,发现有气泡产生(如图3),于是他们对这个异常现象进行了探究。

(6)对气体成分的探究:加热二氧化锰样品,用燃着的木条靠近试管口,木条熄灭。将气体通入澄清的石灰水,发现石灰水变浑浊,产生的气体是 。
(7)对气体来源的探究:
【假设1】甲同学认为:该气体来自于试管中的空气,请你设计实验证明该假设是否成立。
实验步骤及现象 | 结论 |
按图3装置,加热空的试管,另一端的澄清石灰水没有变浑浊 | 假设 (填“成立”或“不成立”)。 |
【假设2】乙同学认为:二氧化锰样品中可能混有炭粉,炭粉发生反应生成了该气体。他通过查阅资料得知:氢氧化钠溶液会与该气体反应,从而可吸收该气体。于是他设计了如图4所示的装置进行实验,其中B装置的作用是检验A中的反应是否完全,则B中的试剂是 ,实验中观察到D处澄清石灰水变浑浊。他又用氮气代替空气(氮气不参与该实验中的任何反应),重复上述实验,发现D处澄清的石灰水也变浑浊。
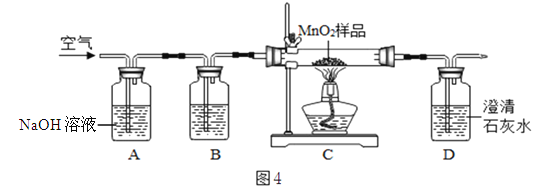
【结论】通过乙同学的实验证明,二氧化锰中混有炭粉,炭粉与 反应产生了这种气体。