题目内容
铝能与浓氢氧化钠反应,生成一种无色无味的气体.(1)请完成该反应的化学方程式:2Al+2NaOH+2H20=2NaAlO2+______;
(2)用10.0g氢氧化钠固体配制20%的氢氧化钠溶液,需加水______mL;
(3)若用上述溶液与铝反应(假设NaOH全部反应).计算反应后所得溶液中NaAlO2的质量分数.(计算结果准确至0.1%)
【答案】分析:(1)根据化学变化前后原子的种类、数目不变,可完成反应化学方程式的填写;
(2)根据溶液质量=溶质质量÷溶质的质量分数,溶剂质量=溶液质量-溶质质量以及水的密度=1.1g/cm3,进行分析解答.
(3)根据化学反应方程式利用氢氧化钠的质量分别计算出生成的NaAlO2和H2的质量以及参加反应的铝的质量,然后利用质量分数公式计算即可.
解答:解:(1)根据质量守恒定律可知:元素种类不变、原子个数不变.由题干中化学方程式的左边有2个铝原子、2个钠原子、4个氧原子和6个氢原子,右边偏铝酸钠中只有2个钠原子、2个铝原子和4个氧原子,因此还缺少6个氢原子,所以横线上应填3H2↑;
故答案为:3H2↑;
(2)用10.0g氢氧化钠固体配制20%的氢氧化钠溶液的质量为:10g÷20%=50g,需加入水的质量为50g-10g=40g,因此加入水的体积是40g÷1.1g/cm3=40mL;
故答案为:40;
(3)设生成NaAlO2的质量为x,氢气的质量是y,参加反应的铝的质量为z,则
2Al+2NaOH+2H20=2NaAlO2+3H2↑
54 80 164 6
z 10g x y
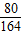 =
=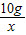 ,解得x=20.5g;
,解得x=20.5g;
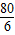 =
=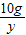 ,解得y=0.75g;
,解得y=0.75g;
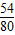 =
=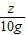 ,解得z=6.75g;
,解得z=6.75g;
反应后所得溶液的质量为6.75g+50g-0.75g=56g,反应后所得溶液中NaAlO2的质量分数为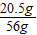 ×100%≈36.6%;
×100%≈36.6%;
答:反应后所得溶液中NaAlO2的质量分数为36.6%.
点评:根据化学变化前后原子的种类、数目不变可以将反应的化学方程式补充完整,掌握根据化学方程式与溶液质量分数结合的计算,难度较大.
(2)根据溶液质量=溶质质量÷溶质的质量分数,溶剂质量=溶液质量-溶质质量以及水的密度=1.1g/cm3,进行分析解答.
(3)根据化学反应方程式利用氢氧化钠的质量分别计算出生成的NaAlO2和H2的质量以及参加反应的铝的质量,然后利用质量分数公式计算即可.
解答:解:(1)根据质量守恒定律可知:元素种类不变、原子个数不变.由题干中化学方程式的左边有2个铝原子、2个钠原子、4个氧原子和6个氢原子,右边偏铝酸钠中只有2个钠原子、2个铝原子和4个氧原子,因此还缺少6个氢原子,所以横线上应填3H2↑;
故答案为:3H2↑;
(2)用10.0g氢氧化钠固体配制20%的氢氧化钠溶液的质量为:10g÷20%=50g,需加入水的质量为50g-10g=40g,因此加入水的体积是40g÷1.1g/cm3=40mL;
故答案为:40;
(3)设生成NaAlO2的质量为x,氢气的质量是y,参加反应的铝的质量为z,则
2Al+2NaOH+2H20=2NaAlO2+3H2↑
54 80 164 6
z 10g x y
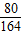 =
=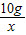 ,解得x=20.5g;
,解得x=20.5g;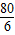 =
=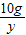 ,解得y=0.75g;
,解得y=0.75g;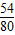 =
=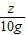 ,解得z=6.75g;
,解得z=6.75g;反应后所得溶液的质量为6.75g+50g-0.75g=56g,反应后所得溶液中NaAlO2的质量分数为
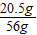 ×100%≈36.6%;
×100%≈36.6%;答:反应后所得溶液中NaAlO2的质量分数为36.6%.
点评:根据化学变化前后原子的种类、数目不变可以将反应的化学方程式补充完整,掌握根据化学方程式与溶液质量分数结合的计算,难度较大.

练习册系列答案
 开心快乐假期作业暑假作业西安出版社系列答案
开心快乐假期作业暑假作业西安出版社系列答案 名题训练系列答案
名题训练系列答案
相关题目