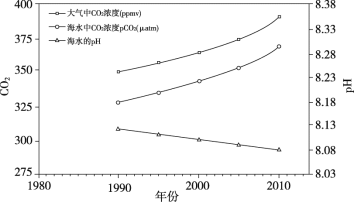
题目内容
【题目】元素周期表中,硫元素的信息如图所示,从图中获得的信息不正确的是( )
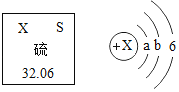
A. 在硫原子的核外电子排布中a=2和b=8
B. 一个硫原子的相对原子质量是32.06g
C. 硫原子在化学反应中易获得2个电子形成硫离子,硫离子中:质子数<电子数
D. 硫是非金属元素
【答案】B
【解析】A、原子核外第一层上最多能容纳2个电子,第二层上最多能容纳8个电子,在硫原子的核外电子排布中a=2和b=8,故选项说法正确。
B、根据元素周期表中的一格可知,汉字下面的数字表示相对原子质量,该元素的相对原子质量为32.06,相对原子质量单位是“1”,不是“克”,故选项说法错误。
C、由硫原子的结构示意图,最外层电子数是6,在化学反应中易得到2个电子而形成阴离子,硫离子中:质子数<电子数,故选项说法正确。
D、硫带“石”字旁,属于非金属元素,故选项说法正确

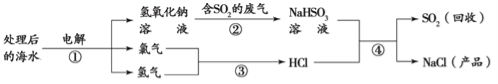
【题目】绿矾被广泛用于医药和工业领域。工业上利用黄铜矿粉(含杂质)主要成分为CuFeS2制取绿矾(FeSO4·7H2O)的流程图如下
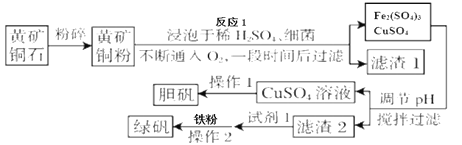
(相关资料)
①氢氧化亚铁不稳定,在空气中容易被氧气氧化成氢氧化铁。
②三价铁离子能和金属铁反应,方程式为:Fe2(SO4)3 + Fe = 3FeSO4
③FeSO4易溶于水但不溶于乙醇。
④部分阳离子以氢氧化物形式完全沉淀时溶液的pH见下表。
沉淀物 | 开始沉淀pH | 沉淀完全pH |
Cu(OH)2 | 4.2 | 6.7 |
Fe(OH)2 | 7.6 | 9.7 |
Fe(OH)3 | 1.5 | 2.8 |
(问题解答)
(1)将黄铜矿粉粹的目的是____________。
(2)在调节pH时,为了将滤渣2充分转化为沉淀而析出,需要调节溶液pH的范围为____________。在调节pH时常用铁的氧化物来调节,不选用NaOH溶液进行调节,理由是_______。
(3)最后得到的绿矾晶体用乙醇洗涤,不用水进行洗涤的目的是_______。
(4)黄铜矿粉能够在细菌作用下,与硫酸和氧气发生反应,请写出反应1的化学方程式_______
【题目】在一支试管中放入一小段镁条(已擦去氧化膜),再向试管中加入一定量的盐酸,镁条表面有________产生,反应的化学方程式是________________________________________________________。
[发现问题]为了再次观察上述反应现象,小林同学用较长的镁条重做上述实验,但发现了异常现象,试管中出现了白色沉淀。
[实验验证1]小林同学针对两次实验的不同,设计对比实验方案,探究出现异常现象的原因。
试管(盛有同体积同浓度的盐酸) | ① | ② | ③ | ④ |
镁条长度 | 1cm | 2cm | 3cm | 4cm |
相同的实验现象(省略题干现象) | 快速反应,试管发热,镁条全部消失 | |||
沉淀量差异(恢复至20℃) | 无 | 少量 | 较多 | 很多 |
[得出结论]镁条与盐酸反应产生白色沉淀与________有关。
[追问]白色沉淀是什么物质?
[查阅资料]①20 ℃时,100 g水中最多能溶解氯化镁54.8 g;
②镁能与热水反应产生一种碱和氢气;
③氯化银既不溶于水也不溶于稀硝酸。
[做出猜想]猜想一:镁;猜想二:氯化镁;猜想三:氢氧化镁,猜想的依据是____________________(用化学方程式表示)。
[实验验证2]将白色沉淀洗涤干净,分别取少量沉淀于A、B、C试管中,进行如表实验:
试管 | 操作 | 现象 | 结论 |
A | 加入足量盐酸 | ________,白色沉淀________ | 猜想一不正确,但这种白色沉淀能溶于盐酸 |
B | 加入足量水 | 白色沉淀________ | 猜想二不正确 |
C | 加入适量稀硝酸 | 白色沉淀消失 | 原白色沉淀中含有的离子是: |
继续滴加几滴硝酸银溶液 | 出现大量白色沉淀 |