题目内容
某学生做锌和稀硫酸反应的五组对比实验,实验结果记录如下:| 组序 | 加入锌的质量/g | 硫酸溶液体积/mL | 生成硫酸锌的质量/g |
| 1 | 1.30 | 40.0 | 3.20 |
| 2 | 2.60 | 40.0 | x |
| 3 | 3.90 | 40.0 | 9.60 |
| 4 | 5.20 | 40.0 | 10.6 |
| 5 | 6.50 | 40.0 | y |
(2)上述五组实验中,反应后硫酸有剩余的是______(填组序号);
(3)若求该稀硫酸的溶质质量分数,还需要的数据是______.
【答案】分析:(1)根据生成硫酸锌的质量随加入锌的质量的变化关系得出硫酸锌的质量;
(2)根据表中第四次数据中的硫酸锌质量求出所消耗的锌的质量,然后计算剩余固体质量;
(3)根据第4次数据可求出硫酸的质量,而求稀硫酸的质量需要知道稀硫酸的密度.
解答:解:(1)根据实验数据,锌粒每增加1.3g,生成的硫酸锌就增加3.20g,当消耗锌2.6克时,应生成硫酸锌的质量= ×3.2g=6.4g.
×3.2g=6.4g.
设生成10.6g硫酸锌时,反应掉的锌的质量为x
Zn+H2SO4═ZnSO4+H2↑
65 161
x 10.6g
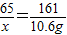
x≈4.28g
当硫酸反应完全时反应掉的锌的质量为4.28g;故增加锌的质量硫酸锌的质量不再增加;第5次实验中硫酸锌的质量仍为10.6g;
(2)当硫酸反应完全时反应掉的锌的质量为4.28g;第4次实验硫酸完全反应,锌有剩余;当第5次实验中金属锌的质量增加时,硫酸已消耗完毕;故上述五组实验中,反应后硫酸有剩余的是1、2、3组
(3)稀硫酸的溶质质量分数= ×100%,硫酸的质量可通过第4次硫酸锌的质量根据化学方程式求出,而稀硫酸的质量=稀硫酸的体积×密度,而稀硫酸密度不知,因此需要知道稀硫酸的密度.
×100%,硫酸的质量可通过第4次硫酸锌的质量根据化学方程式求出,而稀硫酸的质量=稀硫酸的体积×密度,而稀硫酸密度不知,因此需要知道稀硫酸的密度.
故答案为:(1)6.40 10.6 (2)1、2、3 (3)稀硫酸的密度
点评:综合分析数据,找出量之间的关系分析反应物与生成物之间的质量关系,分析出物质的剩余,选择计算的数据一定是被完全反应的物质,这样才可以正确求出相应的未知量.
(2)根据表中第四次数据中的硫酸锌质量求出所消耗的锌的质量,然后计算剩余固体质量;
(3)根据第4次数据可求出硫酸的质量,而求稀硫酸的质量需要知道稀硫酸的密度.
解答:解:(1)根据实验数据,锌粒每增加1.3g,生成的硫酸锌就增加3.20g,当消耗锌2.6克时,应生成硫酸锌的质量=
 ×3.2g=6.4g.
×3.2g=6.4g.设生成10.6g硫酸锌时,反应掉的锌的质量为x
Zn+H2SO4═ZnSO4+H2↑
65 161
x 10.6g
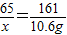
x≈4.28g
当硫酸反应完全时反应掉的锌的质量为4.28g;故增加锌的质量硫酸锌的质量不再增加;第5次实验中硫酸锌的质量仍为10.6g;
(2)当硫酸反应完全时反应掉的锌的质量为4.28g;第4次实验硫酸完全反应,锌有剩余;当第5次实验中金属锌的质量增加时,硫酸已消耗完毕;故上述五组实验中,反应后硫酸有剩余的是1、2、3组
(3)稀硫酸的溶质质量分数=
 ×100%,硫酸的质量可通过第4次硫酸锌的质量根据化学方程式求出,而稀硫酸的质量=稀硫酸的体积×密度,而稀硫酸密度不知,因此需要知道稀硫酸的密度.
×100%,硫酸的质量可通过第4次硫酸锌的质量根据化学方程式求出,而稀硫酸的质量=稀硫酸的体积×密度,而稀硫酸密度不知,因此需要知道稀硫酸的密度.故答案为:(1)6.40 10.6 (2)1、2、3 (3)稀硫酸的密度
点评:综合分析数据,找出量之间的关系分析反应物与生成物之间的质量关系,分析出物质的剩余,选择计算的数据一定是被完全反应的物质,这样才可以正确求出相应的未知量.

练习册系列答案
 导学全程练创优训练系列答案
导学全程练创优训练系列答案
相关题目
某学生做锌和稀硫酸反应的五组对比实验,实验结果记录如下:
| 组序 | 加入锌的质R/g | 硫酸溶液体积/mL | 生成硫酸锌的质量/g |
| 1 | 1.30 | 40.O | 3.20 |
| 2 | 2.60 | 40.O | x |
| 3 | 3.90 | 40.O | 9.60 |
| 4 | 5.20 | 40.O | 10.6 |
| 5 | 6.50 | 40.O | y |
(2)上述五组实验中,反应后硫酸有剩余的是________(填组序号);
(3)若该实验用的稀硫酸密度为1.1 0g?mL-1,列式计算硫酸的质量分数.
某学生做锌和稀硫酸反应的五组对比实验,实验结果记录如下:
| 组序 | 加入锌的质量/g | 硫酸溶液体积/mL | 生成硫酸锌的质量/g |
| 1 | 1.30 | 40.0 | 3.20 |
| 2 | 2.60 | 40.0 | x |
| 3 | 3.90 | 40.0 | 9.60 |
| 4 | 5.20 | 40.0 | 10.6 |
| 5 | 6.50 | 40.0 | y |
(2)上述五组实验中,反应后硫酸有剩余的是______(填组序号);
(3)若求该稀硫酸的溶质质量分数,还需要的数据是______.