题目内容
 如图是甲、乙、丙三种物质(不含结晶水)的溶解度曲线.现有t2℃时甲、乙、丙三种物质的饱和溶液(无固体共存).请根据图回答:
如图是甲、乙、丙三种物质(不含结晶水)的溶解度曲线.现有t2℃时甲、乙、丙三种物质的饱和溶液(无固体共存).请根据图回答:(1)t2℃将三种饱和溶液分别恒温蒸发相同质量的水,析出晶体最多的是
甲
甲
.(2)将甲、乙、丙三种物质的饱和溶液分别从t2℃降温到t1℃时,所得溶液中溶质的质量分数由大到小的顺序为(用“>”或“=”号连接)
乙>甲>丙
乙>甲>丙
.(3)当甲中含有少量乙时,可采用
降温结晶(或冷却热饱和溶液)
降温结晶(或冷却热饱和溶液)
方法提纯甲.分析:(1)据t2℃三种物质的溶解度分析解答;
(2)据三种物质的溶解度随温度变化及饱和溶液中溶质的质量分数进行判断;
(3)甲的溶解度随温度变化较大,乙的溶解度受温度影响不大,所以提纯甲可用降温结晶的方法.
(2)据三种物质的溶解度随温度变化及饱和溶液中溶质的质量分数进行判断;
(3)甲的溶解度随温度变化较大,乙的溶解度受温度影响不大,所以提纯甲可用降温结晶的方法.
解答:解:(1)t2℃三种物质的溶解度由大到小的顺序是甲>乙>丙,所以将三种饱和溶液分别恒温蒸发相同质量的水,析出晶体最多的是甲;
(2)t2℃三种物质的溶解度由大到小的顺序是甲>乙>丙,据饱和溶液质量分数的计算式
×100%可知:溶解度越大质量分数也就越大;所以将甲、乙、丙三种物质的饱和溶液分别从t2℃降温到t1℃时,甲、乙析出晶体,丙变为不饱和溶液,溶质质量分数与降温前相等,t1℃时乙的溶解度大于甲的溶解度大于丙的溶解度,所以所得溶液中溶质的质量分数由大到小的顺序为:乙>甲>丙;
(3)甲的溶解度随温度变化较大,乙的溶解度受温度影响不大,所以当甲中含有少量乙时,可采用降温结晶或冷却热饱和溶液的方法;
故答案为:(1)甲;(2)乙>甲>丙;(3)降温结晶(或冷却热饱和溶液).
(2)t2℃三种物质的溶解度由大到小的顺序是甲>乙>丙,据饱和溶液质量分数的计算式
| 溶解度 |
| 溶解度+100g |
(3)甲的溶解度随温度变化较大,乙的溶解度受温度影响不大,所以当甲中含有少量乙时,可采用降温结晶或冷却热饱和溶液的方法;
故答案为:(1)甲;(2)乙>甲>丙;(3)降温结晶(或冷却热饱和溶液).
点评:本题主要考查了溶解度曲线知识的意义及应用,难度不大.

练习册系列答案
相关题目
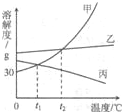 (2011?保山)如图是甲、乙、丙三种固体物质的溶解度曲线.下列说法不正确的是( )
(2011?保山)如图是甲、乙、丙三种固体物质的溶解度曲线.下列说法不正确的是( )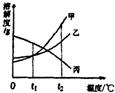 10、如图是甲、乙、丙三种物质的溶解度曲线,则下列有关说法不正确的是( )
10、如图是甲、乙、丙三种物质的溶解度曲线,则下列有关说法不正确的是( ) 5、如图是甲、乙、丙三种物质的溶解度曲线,下面说法不正确的是( )
5、如图是甲、乙、丙三种物质的溶解度曲线,下面说法不正确的是( )

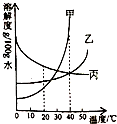 如图是甲、乙、丙三种固体(均不含结晶水)的溶解度曲线.20℃时,烧杯中分别盛有相同质量的甲、乙、丙饱和溶液,各加入等质量的对应固体,并升温至40℃,观察到,甲固体逐渐减少至全部溶解,下列判断正确的是( )
如图是甲、乙、丙三种固体(均不含结晶水)的溶解度曲线.20℃时,烧杯中分别盛有相同质量的甲、乙、丙饱和溶液,各加入等质量的对应固体,并升温至40℃,观察到,甲固体逐渐减少至全部溶解,下列判断正确的是( )