题目内容
地球上总储水量很大,但淡水很少,海水中溶解了很多物质,又苦又咸,除了含H2O外,还含有大量的Na+、Ca2+、Cl-、Mg2+、SO42-等.以海水为原料提取食盐的工艺流程如图: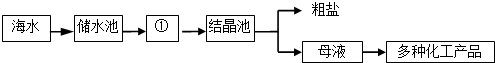
(1)图中①是
(2)根据海水晒盐的原理,下列说法中不正确的是
A.得到的粗盐是纯净的氯化钠
B.在①中,海水中水的质量逐渐减少
C.在①中,海水中氯化钠的质量逐渐增加
D.海水进入贮水池,海水的成分基本不变
(3)根据上述及工艺流程图,母液中所含的离子有
A.Ca2+、Mg2+、SO42- 等 B.Na+、Ca2+、Cl-、Mg2+、SO42-、H2O等
C.Ca2+、Mg2+、SO42-、H2O等 D.Na+、Ca2+、Cl-、Mg2+、SO42-等.
分析:(1)根据氯化钠的溶解度受温度的影响来分析;
(2)海水晒盐的原理是:利用阳光和风力的作用,使水不断蒸发,氯化钠溶液越来越浓,当水蒸发到一定程度时,形成氯化钠的饱和溶液,再继续蒸发时,就会有氯化钠晶体析出;
(3)粗盐中含有氯离子、钠离子和少量其他离子.
(2)海水晒盐的原理是:利用阳光和风力的作用,使水不断蒸发,氯化钠溶液越来越浓,当水蒸发到一定程度时,形成氯化钠的饱和溶液,再继续蒸发时,就会有氯化钠晶体析出;
(3)粗盐中含有氯离子、钠离子和少量其他离子.
解答:解:(1)因为氯化钠的溶解度水温度影响比较小,故应采取蒸发结晶的方法;
(2)A.粗盐中含有泥沙等难溶性杂质和一些可溶性杂质,故不是纯净的氯化钠;
B.随着蒸发的不断进行,溶剂水不断减少;
C.在蒸发的过程中,溶液中氯化钠的质量不变,但是氯化钠的质量分数变大;
D.海水进入贮水池,氯化钠溶液的成分基本不变;
故选AC;
(3)大部分食盐在结晶析出的同时,也会有很少的其他的晶体从溶液中结晶析出,但溶液中仍旧会有少量的氯化钠,母液中可能含有的离子是:Na+、Ca2+、Cl-、Mg2+、SO42-.
故答案为:(1)蒸发;(2)AC;(3)D.
(2)A.粗盐中含有泥沙等难溶性杂质和一些可溶性杂质,故不是纯净的氯化钠;
B.随着蒸发的不断进行,溶剂水不断减少;
C.在蒸发的过程中,溶液中氯化钠的质量不变,但是氯化钠的质量分数变大;
D.海水进入贮水池,氯化钠溶液的成分基本不变;
故选AC;
(3)大部分食盐在结晶析出的同时,也会有很少的其他的晶体从溶液中结晶析出,但溶液中仍旧会有少量的氯化钠,母液中可能含有的离子是:Na+、Ca2+、Cl-、Mg2+、SO42-.
故答案为:(1)蒸发;(2)AC;(3)D.
点评:海水是一种宝贵的自然资源,海水晒盐利用很多化学原理,体现了化学源于生活,又服务于生活的理念.

练习册系列答案
 愉快的寒假南京出版社系列答案
愉快的寒假南京出版社系列答案
相关题目

 水是人及一切生物生存所必需的,为了人类和社会经济的可持续发展,我们应该了解一些有关水的知识.请你回答:
水是人及一切生物生存所必需的,为了人类和社会经济的可持续发展,我们应该了解一些有关水的知识.请你回答: