题目内容
【题目】过氧化钠与水在常温下发生如下化学反应:2Na2O2+2H2O=4NaOH+O2↑。现将20g不纯的过氧化钠样品(其中杂质不与水反应)放入足量的水中,待完全反应后,生成2.24L氧气(氧气的密度是1.43g·L-1)。请计算:
(1)反应生成氧气的质量_______(计算结果精确到0.1)。
(2)该样品中过氧化钠的质量分数________。
【答案】3.2g 78%
【解析】
(1)根据氧气的体积求出生成氧气的质量即可;
(2)根据氧气的质量求出过氧化钠的质量,进而求出样品中过氧化钠的质量分数即可。
解:(1)反应生成氧气的质量=1.43g·L-1![]() 2.24L
2.24L![]() 3.2g;
3.2g;
(2)设过氧化钠的质量为x,
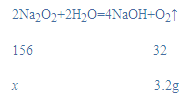
![]()
x=15.6g,
该样品中过氧化钠的质量分数为=![]() ×100%=78%;
×100%=78%;
答:(1)反应生成氧气的质量为3.2g;
(2)该样品中过氧化钠的质量分数为78%。

 发散思维新课堂系列答案
发散思维新课堂系列答案【题目】下图装置可以完成多个简单实验,具有药品用量少、实验现象明显、尾气不外逸等优点。
小资料:Na2 CO3 + H2 SO4 ="Na"2 SO4 + H2 O + CO2 ↑;
氧化钙(俗称生石灰)与水反应放热。

(1)若甲中吸有浓氨水,乙中吸有无色酚酞溶液,将甲、乙中的液体同时挤出,一段时间后,观察到无色酚酞溶液变红,说明分子具有的性质是________。
(2)若甲中吸有水,乙中吸有稀硫酸,烧杯①中盛有用石蕊溶液染成紫色的干燥纸花,烧杯②中盛有碳酸钠粉末。为了验证使石蕊变色的物质是碳酸而不是二氧化碳,应采取的实验操作是________。
(3)若先将甲中的液体挤出,观察到气球明显鼓起,一段时间后恢复原状;再将乙中的液体挤出,气球又明显鼓起。请将下表中的试剂补充完整。
滴管甲 | 烧杯① | 滴管乙 | 烧杯② | |
试剂 | H2 O | MnO2 |
气球鼓起是因为装置内气压增大,两次气压增大的原因依次是________。