题目内容
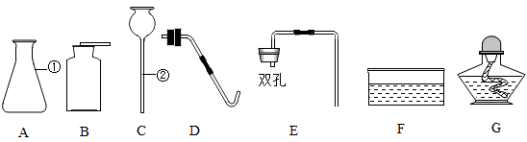
【题目】下列三套装置都能用于实验室制取二氧化碳
(1)写出实验室制取二氧化碳的化学方程式: ,
(2)仪器A的名称是
(3)利用图2装取制取二氧化碳时,长颈漏斗的下端管口必须浸没在溶液中,理由是 ,
(4)图1和图3装置相比.利用图1装置来制取二氧化碳时主要的不足是(写一条即可)
(5)化学兴趣小组为了测定石灰石样品中碳酸钙的质量分数,取一定量的石灰石样品,将20g稀盐酸分4次加人样品中(样品中除碳酸钙外,其余成分不与盐酸反应,也不溶于水).充分反应后经过过滤、干操等操作,最后称量,数据如下表
稀盐用量剩余固体的质量 | |
第一次加入5g | 1.5g |
第二次加入59 | 1.0g |
第三次加入59 | 0.5g |
第四次加入59 | 0.3g |
① 石灰石样品中碳酸钙的质量分数为
②原稀盐酸中溶质的质量分数为多少(写出计其过程)
【答案】
(1)CaCO3+2HCl=CaCl2+H2O+CO2↑
(2)烧瓶
(3)防止产生的气体从长颈漏斗中逸出
(4)不能控制反应的发生和停止
(5)85%,解∶设第一次与碳酸钙反应的氯化氢质量为xg
CaCO3+ | 2HCl═ | CaCl2+H2O+ | CO2↑ |
100 | 73 | ||
0.5g | x |
![]() x=0.365g原稀盐酸中溶质的质量分数为∶0.365g/5g×100%=7.3%答∶原稀盐酸中溶质的质量分数为7.3%
x=0.365g原稀盐酸中溶质的质量分数为∶0.365g/5g×100%=7.3%答∶原稀盐酸中溶质的质量分数为7.3%
【解析】根据所学知识和题中信息知,(1)实验室制取二氧化碳的化学方程式:
CaCO3+2HCl==CaCl2+H2O+CO2↑;(2)仪器A的名称是烧瓶;(3)利用图2装取制取二氧化碳时,长颈漏斗的下端管口必须浸没在溶液中,理由是防止产生的气体从长颈漏斗中逸出;(4)图1和图3装置相比.利用图1装置来制取二氧化碳时主要的不足是不能控制反应的发生和停止;⑸①石灰石样品中碳酸钙的质量分数为∶(2.0g-0.3g)/2g×100%=85%.②原稀盐酸中溶质的质量分数为∶7.3%。
【考点精析】认真审题,首先需要了解书写化学方程式、文字表达式、电离方程式(注意:a、配平 b、条件 c、箭号),还要掌握根据化学反应方程式的计算(各物质间质量比=系数×相对分子质量之比)的相关知识才是答题的关键.