题目内容
【题目】为了探究石灰石的纯度(假设样品中的杂质既不溶于水也不与盐酸反应),称取40g石灰石样品等分为4份(编号为①②③④),每份样品分别与一定量的稀盐酸反应,所得数据如表所示:
样品编号 | ① | ② | ③ | ④ |
稀盐酸的质量 | 25g | 50g | m(80g<m<150g) | 150g |
剩余固体的质量 | 7.5g | 5g | 2g | 2g |
为了探究石灰石与稀盐酸反应后所得溶液中的溶质成分,将编号③所得溶液过滤,取滤液质量的1/4于烧杯中,向其中滴加质量分数为10.6%的碳酸钠溶液使其充分反应直至过量,有关沉淀质量的变化如图所示,请回答下列问题:
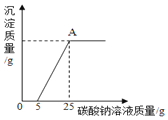
(1)该石灰石样品的纯度为______;盐酸溶液的溶质质量分数为______。
(2)编号③所用稀盐酸的质量m为______g。
(3)A点处对应的溶液中溶质的质量是多少_____?(写出计算过程)
【答案】80% 7.3% 100 2.925g
【解析】
(1)在加入稀盐酸的质量分别为m(80g<m<150g)和150g时,剩余固体的质量均为2g,说明当加入150g稀盐酸时,石灰石全部反应完全,剩余固体为杂质,故该石灰石样品的纯度为![]() ×100%=80%。
×100%=80%。
设盐酸的质量分数为x,
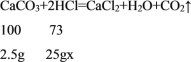
![]()
x=7.3%
答:盐酸的质量分数为7.3%。
(2)对于编号为③的10g石灰石样品,设此时参加反应的稀盐酸的质量为y;
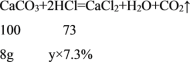
![]()
y=80g
将编号③反应所得溶液过滤,取滤液质量的1/4于烧杯中,向其中滴加质量分数为10.6%的碳酸钠溶液使其充分反应直至过量,根据沉淀质量的变化图可知,当碳酸钠加入量为0-5g时,沉淀没有生成,说明溶液中有过量的稀盐酸,稀盐酸与碳酸钠反应可以生成氯化钠、水、二氧化碳。设编号③步骤2中碳酸钠消耗的盐酸质量为b,生成氯化钠质量为n,
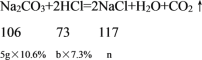
![]()
b=5g
n=0.585g
所以编号③步骤1中的1/4滤液所用稀盐酸的质量为5g,则全部滤液将消耗4×5g=20g,
故编号③所用稀盐酸的质量m=80g+20g=100g;
(3)A点处对应的溶液中溶质的质量是碳酸钠和稀盐酸反应生成的氯化钠以及碳酸钠和氯化钙反应生成的氯化钠的总和。设氯化钙与碳酸钠生成氯化钠的质量为c,
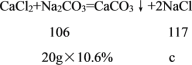
![]()
解得c=2.34g
故所以A点处对应的溶液中溶质的质量为0.585g+2.34g=2.925g。
答:(1)该石灰石样品的纯度为80%;盐酸溶液的溶质质量分数为7.3%。
(2)编号③所用稀盐酸的质量m为100g。
(3)A点处对应的溶液中溶质的质量为2.925g。

 寒假创新型自主学习第三学期寒假衔接系列答案
寒假创新型自主学习第三学期寒假衔接系列答案