题目内容
【题目】某药厂生产的葡萄糖酸锌口服液的标签如下图所示,请回答下列问题:

(1)葡萄糖酸锌是由4种元素组成的,其中,碳、氢、氧、锌元素的原子个数比是______。
(2)其中,碳、氧元素的质量比是_______,含锌元素的质量分数是________(精确到0.1%)。
(3)每支口服液含葡萄糖酸锌45.5 mg,请你计算标签中每支口服液含锌元素的质量为多少mg(写出计算过程)_____。
【答案】12:22:14:1 9:14 14.3% 6.5mg
【解析】
(1)葡萄糖酸锌化学式为C12H22O14Zn,故碳、氢、氧、锌元素的原子个数比=12:22:14:1;
(2)葡萄糖酸锌化学式为C12H22O14Zn,碳、氧元素的质量比=(12×12):(16×14)=9:14;锌元素的质量分数=![]() ×100%≈14.3%;
×100%≈14.3%;
(3)每支口服液含锌元素的质量=45.5mg×![]() ×100%=6.5mg。
×100%=6.5mg。

 阅读快车系列答案
阅读快车系列答案【题目】某化学兴趣小组对氧气的制取进行了进一步探究。
(1)用高锰酸钾制氧气,对比用向上排空气法和排水法收集到的氧气的纯度。
(进行实验)
①用向上排空气法收集氧气:将带火星的木条放在集气瓶口,当_________时证明氧气集满,用传感器测定集气瓶中氧气的体积分数。重复该实验3次并记录数据。
②用排水法收集氧气:氧气能用排水法收集的原因是____,用传感器测定集气瓶中氧气的体积分数。重复该实验3次并记录数据。
氧气的收集方法 | 向上排空气法 | 排水法 | ||||
氧气的体积分数/% | 79.7 | 79.6 | 79.9 | 90.0 | 89.8 | 89.3 |
氧气的平均体积分数/% | 79.7 | 89.7 | ||||
(实验分析)不考虑操作失误的因素,用排水法也收集不到纯净的氧气,其主要原因是__________。
(2)用过氧化氢溶液制氧气,探究不同催化剂催化过氧化氢分解的效果。
(查阅资料)
①MnO2、Cr2O3、Fe2O3、CuO、S对过氧化氢的分解均具有催化作用。
②海藻酸钠可以作为催化剂的载体支架,形成负载不同催化剂的海藻酸钠微球。
(进行实验)
①制备五种负载不同催化剂(MnO2、Cr2O3、Fe2O3、CuO、S)的海藻酸钠微球,每个微球大小相同,且负载催化剂的质量相等。
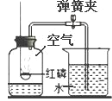
②取30粒负载某种催化剂的海藻酸钠微球与20mL质量分数为5%的过氧化氢溶液,在锥形瓶中迅速混合发生反应,实验装置如图1,采集200s内压强数据,绘制曲线如图2。

(实验分析)
①每次实验时,海藻酸钠微球数应相同的原因是_________。
②本实验中,通过一段时间内______来反映生成氧气的快慢。
③本实验中,负载MnO2的微球显示了良好的催化效果,60s时竟将橡皮塞弹飞,在图2中对应的曲线是_______(填“a”或“b”);负载_______的微球催化效果较好,反应温和;负载Fe2O3、Cr2O3的微球催化效果一般;负载_______的微球催化能力最弱。