题目内容
【题目】常温下,某气体可能是由SO2、CO、N2中的一种或几种组成,测得该气体中氧元素的质量分数为50%,则该气体可能为下列组成中的
① SO2②SO2、CO ③SO2、N2④CO、N2⑤SO2、CO、N2
A.①②③B.②③⑤C.①④⑤D.①②⑤
【答案】C
【解析】
试题推测混合物的组成,可采用平均值法。由于SO2中氧元素的质量分数=![]() ×100%=50%,CO中氧元素的质量分数=
×100%=50%,CO中氧元素的质量分数=![]() ×100%=57%,N2中没有氧元素,则氧元素的质量分数为0。而题中某气体的氧元素质量分数的平均值为50%,所以该气体可能只有一种,即是SO2;也可能是一种大于50%,一种小于50%,即为CO与N2;当然也可能是三种气体的混合物;但不可能出现SO2与N2、SO2与CO的组合。故选C
×100%=57%,N2中没有氧元素,则氧元素的质量分数为0。而题中某气体的氧元素质量分数的平均值为50%,所以该气体可能只有一种,即是SO2;也可能是一种大于50%,一种小于50%,即为CO与N2;当然也可能是三种气体的混合物;但不可能出现SO2与N2、SO2与CO的组合。故选C

 寒假创新型自主学习第三学期寒假衔接系列答案
寒假创新型自主学习第三学期寒假衔接系列答案【题目】学习了MnO2对过氧化氢分解有催化作用的知识后,某同学想:CuO能否起到类似MnO2的催化剂作用呢?于是进行了以下探究。
【猜想】Ⅰ、CuO不是催化剂、也不参与反应,反应前后质量和化学性质不变;
Ⅱ、CuO参与反应产生O2,反应前后质量和化学性质发生了改变;
Ⅲ、CuO是反应的催化剂,反应前后_____________________________。
【实验】用天平称量0.2gCuO,取5mL5%的过氧化氢溶液于试管中,进行如下实验:
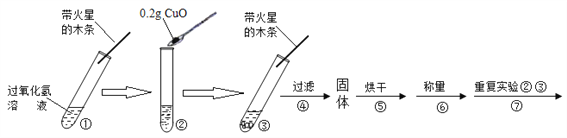
(1)填写下表:
步骤③现象 | 步骤⑥结果 | 步骤⑦现象 | 结论 |
________ 带火星的木条复燃。 | ______ | 溶液中有气泡放出,________ | 猜想Ⅰ、Ⅱ不成立; 猜想Ⅲ成立。 |
(2)步骤①的目的是___________________________________。
(3)步骤④需用到的实验仪器有:铁架台(带铁圈)、漏斗、烧杯、___________。
(4)过氧化氢能被CuO催化分解的化学方程式为_______________________。
【拓展】要探究步骤⑤做过催化剂的CuO其它化学性质,还应补做的实验是____。(写一种)
【题目】某校化学兴趣小组就空气中氧气的含量进行实验探究,请你参与.
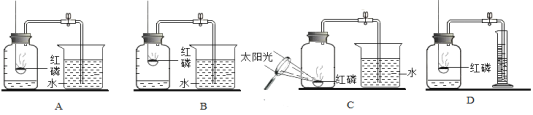
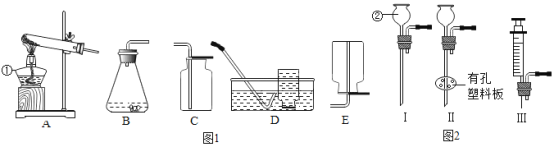
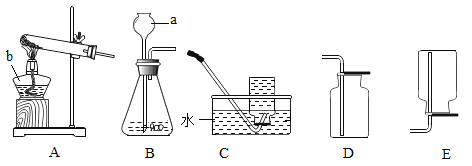
设计实验:第一小组同学共同设计了如图的A、B两套装置.你认为合理的是(填编号)_____进行试验:
数据实验结束后,整理数据如下:(注:集气瓶容积为100mL)
组别 | 1 | 2 | 3 | 4 | 5 | 6 |
进入瓶中水的体积(mL) | 20 | 18 | 19 | 17 | 21 | 19 |
通过对实验数据分析,实验得出氧气约占空气体积的_____。
实验
(1)红磷要过量的原因是_____。
(2)弹簧夹打开的适宜时机是_____。
(3)实验结束,发现测定出的空气中氧气的体积分数低于1/5可能的原因是①_____、②_____、③_____。
改进实验:第二小组同学设计了C实验装置,优点是:_____。