题目内容
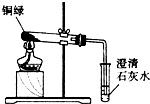
某同学用课本所示装置测定空气里氧气的含量。先用弹簧夹夹紧胶皮管,点燃红磷后立即伸入瓶中并把塞子塞紧。待红磷熄灭并冷却后,打开弹簧夹,观察瓶内水面的变化情况。甲同学的集气瓶内水面上升明显小于瓶内空气体积的1/5,乙同学的集气瓶内水面上升明显大于瓶内空气体积的1/5。下列对这两种现象解释合理的是( )①甲同学可能使用红磷的量不足,瓶内氧气没耗尽;②甲同学可能未塞紧瓶塞,红磷熄灭冷却时外界空气进入瓶内;③乙同学可能没夹紧弹簧夹,红磷燃烧时瓶内部分空气受热从导管逸出;④乙同学可能插入燃烧匙太慢,塞紧瓶塞之前,瓶内部分空气受热逸出。
A ①②③④ B只有①③ C 只有②④ D 只有①②③
A

练习册系列答案
相关题目
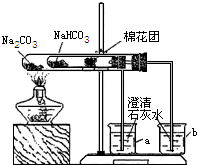 某校同学对市场上的食品疏松剂进行了如下探究.
某校同学对市场上的食品疏松剂进行了如下探究.实验一:甲小组的同学收集到一包主要成分是小苏打(碳酸氢钠)的疏松剂
(1)取样品溶于适量的水中,测得溶液的pH大于7.
(2)向小苏打样品中滴加盐酸,有大量气泡产生,经检验该气体是二氧化碳.该反应的化学方程式为
(3)同学们通过查阅资料,在老师的指导下采用了如图所示装置用小苏打和纯碱做了对比实验.实验中小试管内沾有无水硫酸铜粉末的棉花球变成蓝色,a烧杯中石灰水无明显现象,
b烧杯中石灰水了现白色浑浊.试回答:①在实验结束时,操作上要注意的问题是:
②由实验(3)可以得出的结论是
实验二:乙小组的同学收集到一包名为“臭粉”的疏松剂,为探究其组成,进行实验:
(1)“臭粉”为一种白色固体,易溶于水;
(2)取少量样品与稀盐酸混合后产生了可以使石灰水变混浊的气体;
(3)取少量样品加热后,产生了有刺激性气味的气体;
(4)少量样品与氢氧化钠溶液混合后共热,产生了使湿润的红色石蕊试纸变蓝的臭气.
调查后得知,“臭粉”的主要成分是初中化学课本中一种常见的盐.
①你认为该盐是
②用“臭粉”作疏松剂的油炸食品放置后再销售和食用的原因可能是
③某些小商贩喜欢选用“臭粉”代替“小苏打”作疏松剂的原因可能是
实验三:丙小组同学探究小苏打、“臭粉”在制作食品过程中产生气泡的原因
(1)两种疏松剂产生的气体中都含有
(2)小组的同学将少许面粉加入水中取上层液体用pH试纸测得:pH=7.猜测产生气体的原因是
实验四:丁小组的同学在某超市发现一种复合疏松剂--发酵粉,其成分见表:
| 成分 | 所用物质 |
| 碳酸盐类 | 碳酸氢钠 |
| 酸性物质 | 柠檬酸、酒石酸等 |
| 疏松剂 | 明矾 |
| 其他成分 | 淀粉、脂肪酸等 |
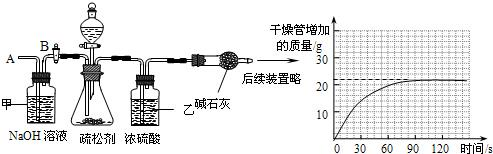
(2)为测定其中碳酸氢钠的质量分数,小组的同学设计了如下实验,其主要实验步骤如下:
Ⅰ.按图组装仪器,将50.0g试样放入锥形瓶中,加入足量某酸溶液;
Ⅱ.测量一定时间内干燥管内物质增加的质量(见下列曲线);
Ⅲ.待锥形瓶中不再产生气泡时,打开活塞B,从导管A处缓缓鼓入一定量的空气;
Ⅳ.再次称量干燥管内物质增加的质量;
Ⅴ.重复Ⅲ和Ⅳ的操作,直至干燥管内物质质量不变.
讨论:
①步骤Ⅰ.加入样品前还应检查
②装置乙的作用是
③请利用有关数据计算试样中碳酸氢钠的质量分数.(写出计算过程,本小题4分)
(7分)2011年是国际化学年(IYC2011),其宗旨是“增进公众对化学重要性的认识,鼓励青年人热爱化学,学习和研究化学”。某校化学兴趣小组的同学,对课本中一氧化碳还原氧化铁实验作了绿色化改进后制取单质铁(K1,K2是活塞):
(1)关闭K1、开启K2,可以验证CO还原Fe2O3的产物。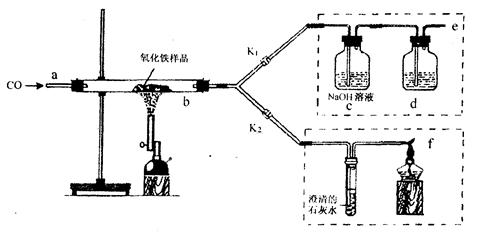
①这是关于气体的实验,实验前必须对装置进行装置的气密性检查
②CO还原Fe2O3的化学方程式为 ;
③在f处点燃气体的目的是 。
(2)关闭K2,开启K1,可以将e口出来的气体再从a通入装置而循环使用。
①d瓶中应装 (填序号)。
| A.澄清石灰水 | B.水 | C.石蕊溶液 | D.浓硫酸 |
(3)小刚用一种不纯的氧化铁粉末样品(杂质为铁粉),通过该实验测定样品中氧化铁的质量分数。小刚称取10g样品,利用上图所示装置进行实验,相关实验数据见下表:(玻璃管内的物质完全反应)

①由上表数据可分析出,反应后硬质玻璃管及所盛固体总质量减少的是 的质量。
②请依据c装置总质量变化的数据,计算出样品中氧化铁的质量分数(写出计算过程)。