题目内容
某研究性学习小组,从下列装置中选用部分装置组装后在实验室里制取氧气,并通过排水量来测定所收集到氧气的体积.
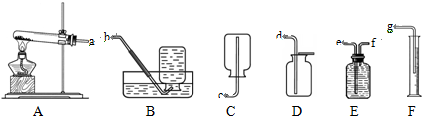
(1)甲同学用一定质量的高锰酸钾制取氧气,反应的化学方程式为______,整套实验装置接口的正确连接顺序为a→______→______→______.
(2)实验过程中,甲同学观察到E装置中的水变为紫红色,这是因为______进入E装置并溶于水中的缘故.为了防止实验过程中出现上述现象,相应的改进措施是______.
(3)实验结束,乙同学意外发现收集到的氧气体积大于理论值,为此继续进行以下实验探究:
提出问题:出现“收集到的氧气体积大于理论值”的原因是什么?
作出猜想:猜想Ⅰ:可能是反应生成的二氧化锰分解放出氧气;
猜想Ⅱ:可能是反应生成的锰酸钾分解放出氧气;
猜想Ⅲ:______.请回答他做出猜想Ⅲ的理由是______.
实验验证:
实验一:取一定质量的二氧化锰于试管中,加热一段时间,冷却后测得固体残留物的质量不变.证明猜想______错误.
实验二:取一定质量的锰酸钾于试管中,加热一段时间______.综合实验一和实验二,证明猜想Ⅱ正确.
反思拓展:实验结束后,经过讨论、交流,丙同学用下列仪器和药品又设计了一个实验方案测定空气中氧气的体积分数.
①带瓶塞的1000mL圆底烧瓶 ②电子天平(称量精确度为0.01g) ③酒精灯 ④某种较活泼的金属粉末(实验过程中需要用到的其他实验用品已省略,实验中有关物质的物理量数据为已知)他的实验步骤是:_____________.再利用实验数据和已知数据就可换算得出空气中氧气的体积分数.

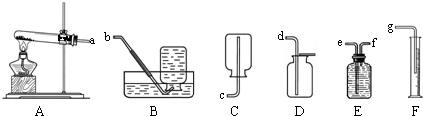
(1)甲同学用一定质量的高锰酸钾制取氧气,反应的化学方程式为______,整套实验装置接口的正确连接顺序为a→______→______→______.
(2)实验过程中,甲同学观察到E装置中的水变为紫红色,这是因为______进入E装置并溶于水中的缘故.为了防止实验过程中出现上述现象,相应的改进措施是______.
(3)实验结束,乙同学意外发现收集到的氧气体积大于理论值,为此继续进行以下实验探究:
提出问题:出现“收集到的氧气体积大于理论值”的原因是什么?
作出猜想:猜想Ⅰ:可能是反应生成的二氧化锰分解放出氧气;
猜想Ⅱ:可能是反应生成的锰酸钾分解放出氧气;
猜想Ⅲ:______.请回答他做出猜想Ⅲ的理由是______.
实验验证:
实验一:取一定质量的二氧化锰于试管中,加热一段时间,冷却后测得固体残留物的质量不变.证明猜想______错误.
实验二:取一定质量的锰酸钾于试管中,加热一段时间______.综合实验一和实验二,证明猜想Ⅱ正确.
反思拓展:实验结束后,经过讨论、交流,丙同学用下列仪器和药品又设计了一个实验方案测定空气中氧气的体积分数.
①带瓶塞的1000mL圆底烧瓶 ②电子天平(称量精确度为0.01g) ③酒精灯 ④某种较活泼的金属粉末(实验过程中需要用到的其他实验用品已省略,实验中有关物质的物理量数据为已知)他的实验步骤是:_____________.再利用实验数据和已知数据就可换算得出空气中氧气的体积分数.
(1)高锰酸钾受热分解生成锰酸钾和二氧化锰和氧气,配平即可,方程式是2KMnO4
K2MnO4+MnO2+O2↑;通过排水量来测定所收集到氧气的体积,整套实验装置接口的正确连接顺序为a→f→e→g;
(2)甲同学观察到E装置中的水变为紫红色,这是因为:试管口没有放棉花团,高锰酸钾粉末进入导管的缘故;因此用高锰酸钾时,试管口要有一团棉花;
(3)作出猜想:化学反应前后元素的种类不变,因为锰酸钾和二氧化锰中都含有氧元素,所以可能是锰酸钾和二氧化锰共同放出氧气;
实验验证:冷却后测得二氧化锰的质量不变,证明猜想Ⅰ和Ⅲ错误;取少量锰酸钾于试管中加,热一段时间,冷却后测得锰酸钾的质量减少,证明猜想Ⅱ正确;
反思拓展:要测定空气中氧气的体积分数,实验方案步骤是:先用电子天平称出金属粉末的质量;再把金属粉末在带瓶塞的1000ml烧瓶灼烧,至氧气充分反应;再称量反应后金属粉末的质量,与反应前金属粉末的差值就是反应的烧瓶中氧气的质量,然后通过密度公式求氧气的体积,结合1000mL空气的体积计算出氧气的体积分数;
故答案为:
(1)2KMnO4
K2MnO4+MnO2+O2↑; f→e→g;
(2)高锰酸钾粉末;在试管口放一团棉花;
(3)作出猜想:可能是锰酸钾和二氧化锰均被分解放出氧气; 锰酸钾和二氧化锰都含有氧元素;
实验验证:Ⅰ和Ⅲ; 冷却后测得固体残留物的质量较原固体减少;
反思拓展:先用电子天平称出稍过量的金属粉末的质量,再把金属粉末放在带瓶塞的1000mL的圆底烧瓶中灼烧,至氧气完全反应;再称量反应后圆底烧瓶中固体物质的质量;最后通过密度公式求氧气的体积.
| ||
(2)甲同学观察到E装置中的水变为紫红色,这是因为:试管口没有放棉花团,高锰酸钾粉末进入导管的缘故;因此用高锰酸钾时,试管口要有一团棉花;
(3)作出猜想:化学反应前后元素的种类不变,因为锰酸钾和二氧化锰中都含有氧元素,所以可能是锰酸钾和二氧化锰共同放出氧气;
实验验证:冷却后测得二氧化锰的质量不变,证明猜想Ⅰ和Ⅲ错误;取少量锰酸钾于试管中加,热一段时间,冷却后测得锰酸钾的质量减少,证明猜想Ⅱ正确;
反思拓展:要测定空气中氧气的体积分数,实验方案步骤是:先用电子天平称出金属粉末的质量;再把金属粉末在带瓶塞的1000ml烧瓶灼烧,至氧气充分反应;再称量反应后金属粉末的质量,与反应前金属粉末的差值就是反应的烧瓶中氧气的质量,然后通过密度公式求氧气的体积,结合1000mL空气的体积计算出氧气的体积分数;
故答案为:
(1)2KMnO4
| ||
(2)高锰酸钾粉末;在试管口放一团棉花;
(3)作出猜想:可能是锰酸钾和二氧化锰均被分解放出氧气; 锰酸钾和二氧化锰都含有氧元素;
实验验证:Ⅰ和Ⅲ; 冷却后测得固体残留物的质量较原固体减少;
反思拓展:先用电子天平称出稍过量的金属粉末的质量,再把金属粉末放在带瓶塞的1000mL的圆底烧瓶中灼烧,至氧气完全反应;再称量反应后圆底烧瓶中固体物质的质量;最后通过密度公式求氧气的体积.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目

 (2012?临沂模拟)某研究性学习小组选择从空气中制取氮气作为研究课题,如图是他们设计的实验方案,请回答问题:
(2012?临沂模拟)某研究性学习小组选择从空气中制取氮气作为研究课题,如图是他们设计的实验方案,请回答问题: