题目内容
KNO3、NaCl溶液在生产、生活中起着十分重要的作用.下表是它们在不同温度时的溶解度,如图一是它们的溶解度曲线.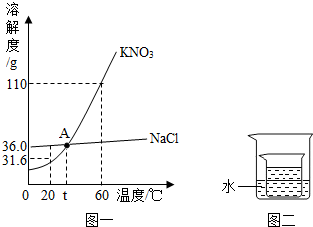
(1)以上两种物质溶解度的变化受温度影响较小的是
(2)30℃时,KNO3的溶解度是
(3)图中A点的含义是
(4)某同学做了如下两个实验.实验1:20℃时,100g水
a
c
实验2:20℃时,100g水
d
e
f
判断a~f对应的溶液中,为饱和溶液的是
由实验1、2可知,使不饱和溶液转化为饱和溶液的方法有
(5)如图二所示,小烧杯中盛放的是实验1中的KNO3溶液b.若将少量的下列物质分别小心地加入到大烧杯的水中,不断搅拌,一定能够使小烧杯中有固体析出的是
A.冰 B.氧化钙 C.硝酸铵 D.干冰 E固体氢氧化钠.

| 温度/℃ | 0 | 10 | 20 | 30 | 40 | 50 | 60 |
| KNO3 | 13.3 | 20.9 | 31.6 | 45.8 | 63.9 | 85.5 | 110 |
| NaCl | 35.7 | 35.8 | 36.0 | 36.3 | 36.6 | 37.0 | 37.8 |
NaCl
NaCl
.(2)30℃时,KNO3的溶解度是
45.8
45.8
g.(3)图中A点的含义是
t℃时,NaCl和KNO3的溶解度相同
t℃时,NaCl和KNO3的溶解度相同
.(4)某同学做了如下两个实验.实验1:20℃时,100g水
| 加入25gKNO3 |
| 充分搅拌 |
| 加入25gKNO3 |
| 升温到60℃ |
| 降温到20℃ |
实验2:20℃时,100g水
| 加入25gNaCl |
| 充分搅拌 |
| 加入25gNaCl |
| 充分搅拌 |
| 加入25g水 |
| 充分搅拌 |
判断a~f对应的溶液中,为饱和溶液的是
ce
ce
;由实验1、2可知,使不饱和溶液转化为饱和溶液的方法有
降低温度;增加溶剂(水)
降低温度;增加溶剂(水)
.(5)如图二所示,小烧杯中盛放的是实验1中的KNO3溶液b.若将少量的下列物质分别小心地加入到大烧杯的水中,不断搅拌,一定能够使小烧杯中有固体析出的是
ACD
ACD
(填字母).A.冰 B.氧化钙 C.硝酸铵 D.干冰 E固体氢氧化钠.
分析:(1)根据题给表格中数据的信息来进行解答;(2)根据表格中硝酸钾的溶解度数值考虑;(3)从溶解度曲线中交点表示的意义考虑;(4)根据硝酸钾和氯化钠不同温度下的溶解度来进行解答;(5)根据物质溶于水吸热,使溶液温度降低来解答.
解答:(1)从表中数据可分析出,氯化钠的溶解度受温度的变化影响较小;
(2)先在表格中找出30℃,再看对应的硝酸钾的溶解度数值是45.8g;
(3)溶解度曲线的交点表示该温度下两种物质溶解度相等,所以A点表示t℃氯化钠与硝酸钾的溶解度相等;
(4)分析实验1结合题给的硝酸钾在不同温度下的溶解度可以知道:溶液中溶解了硝酸钾50g而最终的温度为20℃,而在20℃时硝酸钾的溶解度为31.6g,所以c溶液为饱和溶液,分析实验2并结合题给的氯化钠在不同温度下的溶解度可以知道:在20℃时氯化钠的溶解度为36.0g,而实验中两次共加入了50g,所以在第二次加入氯化钠后得到的溶液e为饱和溶液,此时没有溶解的氯化钠的质量为50g-36g=14g,根据溶解度的定义可以知道,在20℃时,100g水中能溶解氯化钠的质量为36.0g,所以25g水中只能溶解9g氯化钠,而剩余了14g氯化钠不能被全部溶解,所以在加入25g水后所得的溶液f仍然是饱和溶液,根据刚才的分析可以知道,使不饱和溶液转化为饱和溶液可以向溶液中加入溶质或是降低温度.
(5)使硝酸钾溶液析出晶体,说明硝酸钾的溶解度减小了,才会析出晶体,所以向水中加入的物质能使温度降低就可以,冰、硝酸铵、干冰溶于水,都能使溶液温度降低;氧化钙、氢氧化钠固体溶于水放出热量,会使溶液温度升高.
故答案为:(1)NaCl; (2)45.8;(3)t℃时,NaCl和KNO3的溶解度相同;(4)c e; 降低温度;增加溶剂(水);(5)A C D.
(2)先在表格中找出30℃,再看对应的硝酸钾的溶解度数值是45.8g;
(3)溶解度曲线的交点表示该温度下两种物质溶解度相等,所以A点表示t℃氯化钠与硝酸钾的溶解度相等;
(4)分析实验1结合题给的硝酸钾在不同温度下的溶解度可以知道:溶液中溶解了硝酸钾50g而最终的温度为20℃,而在20℃时硝酸钾的溶解度为31.6g,所以c溶液为饱和溶液,分析实验2并结合题给的氯化钠在不同温度下的溶解度可以知道:在20℃时氯化钠的溶解度为36.0g,而实验中两次共加入了50g,所以在第二次加入氯化钠后得到的溶液e为饱和溶液,此时没有溶解的氯化钠的质量为50g-36g=14g,根据溶解度的定义可以知道,在20℃时,100g水中能溶解氯化钠的质量为36.0g,所以25g水中只能溶解9g氯化钠,而剩余了14g氯化钠不能被全部溶解,所以在加入25g水后所得的溶液f仍然是饱和溶液,根据刚才的分析可以知道,使不饱和溶液转化为饱和溶液可以向溶液中加入溶质或是降低温度.
(5)使硝酸钾溶液析出晶体,说明硝酸钾的溶解度减小了,才会析出晶体,所以向水中加入的物质能使温度降低就可以,冰、硝酸铵、干冰溶于水,都能使溶液温度降低;氧化钙、氢氧化钠固体溶于水放出热量,会使溶液温度升高.
故答案为:(1)NaCl; (2)45.8;(3)t℃时,NaCl和KNO3的溶解度相同;(4)c e; 降低温度;增加溶剂(水);(5)A C D.
点评:此题是对固体溶解度知识的考查,解题时借助图表的信息对题目的要求进行分析探讨即可,熟记常见物质的溶解度受温度的影响.

练习册系列答案
 小学生10分钟口算测试100分系列答案
小学生10分钟口算测试100分系列答案
相关题目
 25、如图是几种固体物质的溶解度曲线.请根据图回答下列问题:
25、如图是几种固体物质的溶解度曲线.请根据图回答下列问题: 25、右图为NaNO3、KNO3、NaCl、和KCl 的溶解度曲线.请回答下面提出的问题:
25、右图为NaNO3、KNO3、NaCl、和KCl 的溶解度曲线.请回答下面提出的问题: