题目内容
【题目】某白色固体A可能含有碳酸钠、氧化钙、氯化钠中的一种或几种,进行如下实验:

完成下列问题:
①操作I的名称是___________。根据上述实验流程分析,A中一定含有的物质是__________,C中一定含有的溶质是________。
②为进一步确定固体A中可能存在的物质,对滤液C进行实验,完成下表。
实验操作 | 现象 | 结论 |
用一支洁净的试管取适量滤液C,___________。 | _________________ | A中有氯化钠 |
【答案】 过滤 碳酸钠、氧化钙 氢氧化钠 滴加足量稀硝酸和硝酸银溶液 产生白色沉淀
【解析】①白色固体A中加入水后得到了沉淀,那么固体A中一定含有氧化钙很软碳酸钠:氧化钙与水反应生成氢氧化钙,氢氧化钙与碳酸钠反应生成碳酸钙沉淀和氢氧化钠,由于该实验中没有碰到氯化钠的存在,故滤液C中一定含有氢氧化钠,可能含有氯化钠;通过操作I分别得到了固体和液体,故操作I是过滤;②碰到滤液中是否含有氯化钠,实际是判断是否含有氯离子。氯离子的检验方法是:用一支洁净的试管取适量滤液C,滴加足量稀硝酸和硝酸银溶液,若产生白色沉淀,则证明滤液中含有氯离子,即含有氯化钠。

 阅读快车系列答案
阅读快车系列答案【题目】常温下没有氧气存在时,铁与水几乎不反应,但高温下,铁与水蒸气能反应生成一种常见铁的氧化物和一种气体。小明很好奇,设计如下实验探究铁粉与水蒸气反应后的产物。
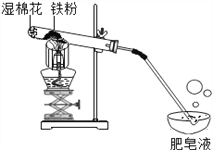
(1) 试管尾部放一团湿棉花的目的是__________________。
(2) 探究生成的气体是什么?
用燃着的木条靠近肥皂泡,有爆鸣声,稍后有肥皂泡飘到空中。说明生成的气体是____________。
(3) 探究试管中剩余固体成分是什么?
【查阅资料】
常见铁的氧化物 | FeO | Fe2O3 | Fe3O4 |
颜色、状态 | 黑色粉末 | 红棕色粉末 | 黑色晶体 |
能否被磁铁吸引 | 否 | 否 | 能 |
以上铁的氧化物在稀盐酸中均能全部溶解,且生成对应的化合物。
【初步验证】试管中剩余固体为黑色,能全部被磁铁吸引。
【猜想与假设】猜想一:剩余固体是Fe与Fe3O4;猜想二:剩余固体是________________。
【实验探究】
实验操作 | 实验现象及结论 |
________________________________ | 若 ___________________,则猜想一正确。 若 ______________________,则猜想二正确。 |
【反思与交流】该黑色固体不可能是Fe2O3,理由是________________________________。
【题目】干燥剂“碱石灰”是氧化钙和氢氧化钠的混合物,在空气中容易变质。某研究小组对一只干燥管里的“碱石灰”样品的成分进行实验探究。
【提出猜想】
猜想Ⅰ:没有变质,只含有氧化钙和氢氧化钠。
猜想Ⅱ:部分变质,含有……
猜想Ⅲ:完全变质,只含有碳酸钙、碳酸钠。
【实验探究】
操作 | 现象 | 结论 |
① | 试管外壁发烫,得到浑浊的液体。 | 推测样品中含有_______________ |
② | 滤渣溶解,产生大量气泡。 | 写出产生大量气泡的化学方程式: _______________ |
③ | 产生白色沉淀。 | 写出产生白色沉淀的化学方程式: _______________ |
【小结与思考】
⑴从上述实验现象推断:猜想________成立。
⑵“碱石灰”样品里是否一定含有碳酸钙?请说明理由。____________________________。




