题目内容
课外兴趣小组对一批铁样品(含有杂质,杂质不溶于水,也不与稀硫酸反应)进行分析,甲、乙、丙三位同学分别进行实验,它们的实验数据如下表,请认真分析,回答下列问题:| 甲 | 乙 | 丙 | |
| 烧杯+稀硫酸 | 150g | 100g | 100g |
| 加入的铁样品 | 6g | 6g | 10g |
| 充分反应后,烧杯+剩余物 | 155.8g | 105.8g | 109.8g |
(2)计算铁样品中铁的质量分数.
【答案】分析:(1)根据质量守恒定律、图表信息,三位同学的实验结果都生成了0.2g气体,推断所用样品最少的同学所取用的稀硫酸与铁样品恰好完全反应;
(2)根据铁与硫酸反应的化学方程式和生成氢气质量,列出比例式,就可计算出样品中铁的质量.然后根据质量分数公式计算即可.
解答:解:(1)根据质量守恒定律、图表信息,反应前后物质及装置的质量之差即为生成氢气的质量可知三位同学的实验结果都生成了0.2g气体,所用样品最少的同学所取用的稀硫酸与铁样品恰好完全反应;
(2)设样品中铁的质量为x
Fe+H2SO4=FeSO4+H2↑
56 2
x 0.2g

解得 x=5.6 g
样品中铁的质量分数为: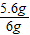 ×100%=93.3%;
×100%=93.3%;
故答案为:(1)乙;(2)答:样品中铁的质量分数为93.3%.
点评:此题是根据化学方程式的计算题,而且题中的数据是以表格的形式给出的,所以此题的关键是通过观察、分析和比较表格中的多组数据,找出有用数据来进行解题.
(2)根据铁与硫酸反应的化学方程式和生成氢气质量,列出比例式,就可计算出样品中铁的质量.然后根据质量分数公式计算即可.
解答:解:(1)根据质量守恒定律、图表信息,反应前后物质及装置的质量之差即为生成氢气的质量可知三位同学的实验结果都生成了0.2g气体,所用样品最少的同学所取用的稀硫酸与铁样品恰好完全反应;
(2)设样品中铁的质量为x
Fe+H2SO4=FeSO4+H2↑
56 2
x 0.2g

解得 x=5.6 g
样品中铁的质量分数为:
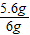 ×100%=93.3%;
×100%=93.3%;故答案为:(1)乙;(2)答:样品中铁的质量分数为93.3%.
点评:此题是根据化学方程式的计算题,而且题中的数据是以表格的形式给出的,所以此题的关键是通过观察、分析和比较表格中的多组数据,找出有用数据来进行解题.

练习册系列答案
 导学全程练创优训练系列答案
导学全程练创优训练系列答案
相关题目
某课外兴趣小组对一批铁样品(含有杂质,杂质不溶于水,也不与稀硫酸反应)进行分析,甲、乙、丙三位同学分别进行实验,其中只有一位同学所取用的稀硫酸与铁样品恰好完全反应.实验数据如下表:
请你认真分析数据,回答下列问题:
(1) 同学所取用的稀硫酸与铁样品恰好完全反应;
(2)计算样品中铁的质量分数;
(3)计算恰好完全反应后所得溶液中溶质的质量分数.(计算结果精确到0.1%)
| 甲 | 乙 | 丙 | |
| 稀硫酸的质量(g) | 200 | 300 | 200 |
| 加入的铁样品的质量(g) | 12 | 12 | 20 |
| 充分反应后,生成气体的质量(g) | 0.4 | 0.4 | 0.4 |
(1)
(2)计算样品中铁的质量分数;
(3)计算恰好完全反应后所得溶液中溶质的质量分数.(计算结果精确到0.1%)
某课外兴趣小组对一批铁样品(含有杂质,杂质不溶于水,也不与稀硫酸反应)进行分析,甲、乙、丙三位同学分别进行实验,其中只有一位同学所取用的稀硫酸与铁样品恰好完全反应.实验数据如下:
请你认真分析数据,回答下列问题:(烧杯的质量为75.4g;计算结果精确到1%)
(1) 同学所取用的稀硫酸与铁样品恰好完全反应;
(2)计算样品中铁的质量分数;
(3)所用稀硫酸的溶质质量分数.
| 甲 | 乙 | 丙 | |
| 烧杯+稀硫酸 | 250g | 200g | 200g |
| 加入的铁样品 | 9g | 9g | 14g |
| 充分反应后,烧杯+剩余物 | 258.7g | 208.7g | 213.7g |
(1)
(2)计算样品中铁的质量分数;
(3)所用稀硫酸的溶质质量分数.