题目内容
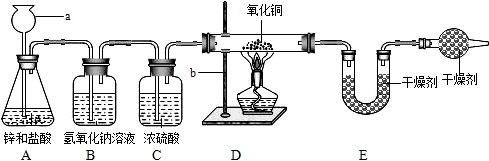
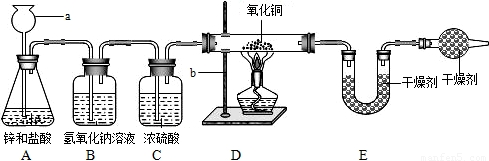
29、某同学利用氢气还原灼热氧化铜的实验测定水的组成(装置如下图).

试回答下列有关问题:
(1)仪器a、b的名称为a
(2)A中可观察到的现象为
(3)B装置的作用是
(4)测定结果如下:实验前后D装置中玻璃管及其固体物质的质量分别为65.6g和59.2g,而实验前后E装置中U型管及其盛放物质的质量分别为100.8g和108.0g.则该同学测定的水中氢跟氧的质量比为
(5)F装置的作用是吸收空气中的水蒸气,如不加F装置,实验结果将会比上述(4)中的测定结果

试回答下列有关问题:
(1)仪器a、b的名称为a
长颈漏斗
,b铁架台(带铁夹)
.(2)A中可观察到的现象为
锌逐渐溶解并产生气泡
,D中可观察到的现象为固体由黑色变为亮红色
.(3)B装置的作用是
除去氢气中混有的氯化氢
,C装置的作用是除去氢气中混有的水蒸气
.(4)测定结果如下:实验前后D装置中玻璃管及其固体物质的质量分别为65.6g和59.2g,而实验前后E装置中U型管及其盛放物质的质量分别为100.8g和108.0g.则该同学测定的水中氢跟氧的质量比为
[(108.0g-100.8g)-(65.6g-59.2g)]:(65.6g-59.2g)=1:8
(必须列出算式并得出结果).(5)F装置的作用是吸收空气中的水蒸气,如不加F装置,实验结果将会比上述(4)中的测定结果
偏高
(选填“偏低”或“偏高”).分析:运用氢气还原氧化铜生成水和铜,题中图示告诉我们氢气用锌和较浓的盐酸反应制得,故氢气中含有氯化氢气体和水蒸气,先要除去它们;D装置减轻的质量就是生成的水中氧元素的质量,U形管增重即生成的水的质量.
解答:解:运用氢气还原氧化铜生成水和铜,题中图示告诉我们氢气用锌和较浓的盐酸反应制得,故氢气中含有氯化氢气体和水蒸气,先用氢氧化钠溶液除去混有的氯化氢,再用浓硫酸 除去氢气中混有的水蒸气;D装置减轻的质量就是CuO中的O失去的质量,是氢气夺走了CuO中的O生成了水,U形管增重的质量就是该反应生成的水的质量,则水中H元素的质量就是水的质量减去O元素的质量,则水中氢跟氧的质量比就是:[(108.0g-100.8g)-(65.6g-59.2g)]:(65.6g-59.2g)=1:8.
故答案:(1)仪器a、b的名称:a 长颈漏斗 b 铁架台(带铁圈)
(2)锌逐渐溶解并产生气泡 固体有黑色变为亮红色
(3)除去氢气中混有的氯化氢 除去氢气中混有的水蒸气
(4)[(108.0g-100.8g)-(65.6g-59.2g)]:(65.6g-59.2g)=1:8
(5)偏高
故答案:(1)仪器a、b的名称:a 长颈漏斗 b 铁架台(带铁圈)
(2)锌逐渐溶解并产生气泡 固体有黑色变为亮红色
(3)除去氢气中混有的氯化氢 除去氢气中混有的水蒸气
(4)[(108.0g-100.8g)-(65.6g-59.2g)]:(65.6g-59.2g)=1:8
(5)偏高
点评:典型的实验探究题,熟练掌握氢气还原氧化铜的性质和实验才能准确解答该题,要分析清楚每步实验的目的即可准确解答该题.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目