题目内容
 如图是浓盐酸试剂瓶上标签的部分内容.请通过计算回答:
如图是浓盐酸试剂瓶上标签的部分内容.请通过计算回答:(1)欲配制200g溶质质量分数为3.65%的稀盐酸,需要这种浓盐酸多少克?
(2)用(1)中所得稀盐酸与足量锌粒反应,最多可得氢气多少克?
分析:(1)这是用浓盐酸配制稀盐酸,根据溶质的质量分数=
×100%首先计算出所所配制的盐酸的溶质的质量,然后在根据浓盐酸的质量分数解出所需浓盐酸的质量.
(2)已知反应物中盐酸的溶质质量,根据稀盐酸与锌反应的化学方程式,可计算生成物的氢气的质量.
| 溶质的质量 |
| 溶液的质量 |
(2)已知反应物中盐酸的溶质质量,根据稀盐酸与锌反应的化学方程式,可计算生成物的氢气的质量.
解答:解:(1)配制200g溶质质量分数为3.65%的稀盐酸的溶质的质量:200×3.65%=7.3(克) 由标签中浓盐酸的溶质的质量分数36.5%,
根据溶质的质量分数=
×100%,则:
这种浓盐酸溶液的质量=
=
=20(克)
(2)由于(1)计算这种稀盐酸中溶质的质量为7.3克,设最多可得氢气X克,根据题意得:
Zn+2HCl=ZnCl2+H2↑
73 2
7.3 克 X克
=
X=0.2克
答:(1)需要这种浓盐酸20克;(2)最多可得氢气0.2克.
根据溶质的质量分数=
| 溶质的质量 |
| 溶液的质量 |
这种浓盐酸溶液的质量=
| 溶质的质量 |
| 溶质的质量分数 |
| 7.3 |
| 36.5% |
(2)由于(1)计算这种稀盐酸中溶质的质量为7.3克,设最多可得氢气X克,根据题意得:
Zn+2HCl=ZnCl2+H2↑
73 2
7.3 克 X克
| 73 |
| 2 |
| 7.3克 |
| X克 |
X=0.2克
答:(1)需要这种浓盐酸20克;(2)最多可得氢气0.2克.
点评:本题考查了用浓盐酸配制稀盐酸的问题和根据化学方程式进行简单的计算,对于浓酸配稀酸,只要抓住溶质的质量不变列关系式即可.

练习册系列答案
相关题目
如图是浓盐酸试剂瓶上标签的部分内容.请回答:
| 盐酸(分析纯) 化学式HCl 质量分数36% 密度1.189/cm3(1)该浓盐酸的溶质是 (2)现要配制3%的稀盐酸120g,需要这种浓盐酸 (3)使用一段时间后,浓盐酸的溶质的质量分数小于36%, 原因是 (4)盐酸等许多酸都能使紫色石蕊试液变红,是因为酸溶液中含有较多的 |
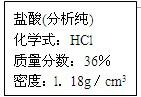 如图是浓盐酸试剂瓶上标签的部分内容.请回答:
如图是浓盐酸试剂瓶上标签的部分内容.请回答: 如图是浓盐酸试剂瓶上标签的部分内容.请回答:
如图是浓盐酸试剂瓶上标签的部分内容.请回答: 如图是浓盐酸试剂瓶上标签的部分内容.请回答:
如图是浓盐酸试剂瓶上标签的部分内容.请回答: