题目内容
某化学兴趣小组为测定固体混合物(Na2CO3和NaCl)中碳酸钠的质量分数,取该样品21.2g放入烧杯中,加水溶解得到154.4g溶液。向该溶液中逐滴加入溶质质量分数为10%的稀盐酸,放出气体的总质量与加入稀盐酸的质量关系如下图所示。
请计算:
(1)该固体混合物中碳酸钠的质量分数。
(2)当恰好完全反应时,所得溶液中溶质的质量分数。
请计算:
(1)该固体混合物中碳酸钠的质量分数。
(2)当恰好完全反应时,所得溶液中溶质的质量分数。
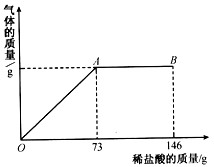
解:73g10%的稀盐酸中含HC1的质量是73g×10% =7:3g。
设参加反应的碳酸钠质量为x,反应生成的氯化钠质量为y,生成的二氧化碳质量为z。
Na2CO3+2HCl==2NaCl+CO2↑+H2O
106 73 111 44
x 7.3g y z
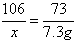 ,x= 10.6g
,x= 10.6g
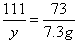 ,y= 11.1g
,y= 11.1g
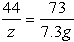 ,z=4.4g
,z=4.4g
(1)固体混合物中Na2CO3的质量分数为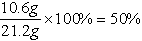
(2)恰好完全反应时烧杯中溶质的质量为11.7g+(21.2g-10.6g)=22.3g
恰好完全反应时烧杯中溶液的质量为73g+154.4g-4.4g=223g
恰好完全反应时溶液中NaCl的质量分数为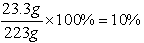
答:该固体混合物中碳酸钠的质量分数为50%,当恰好完全反应时,所得溶液中溶质的质量分数为10%。
设参加反应的碳酸钠质量为x,反应生成的氯化钠质量为y,生成的二氧化碳质量为z。
Na2CO3+2HCl==2NaCl+CO2↑+H2O
106 73 111 44
x 7.3g y z
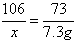 ,x= 10.6g
,x= 10.6g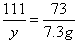 ,y= 11.1g
,y= 11.1g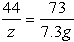 ,z=4.4g
,z=4.4g(1)固体混合物中Na2CO3的质量分数为
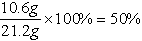
(2)恰好完全反应时烧杯中溶质的质量为11.7g+(21.2g-10.6g)=22.3g
恰好完全反应时烧杯中溶液的质量为73g+154.4g-4.4g=223g
恰好完全反应时溶液中NaCl的质量分数为
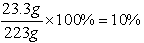
答:该固体混合物中碳酸钠的质量分数为50%,当恰好完全反应时,所得溶液中溶质的质量分数为10%。

练习册系列答案
相关题目
 某化学兴趣小组为测定实验室中一瓶久置的过氧化氢溶液中溶质的质量分数,进行如下实验.
某化学兴趣小组为测定实验室中一瓶久置的过氧化氢溶液中溶质的质量分数,进行如下实验. (2012?乐山二模)某化学兴趣小组为测定一种石灰石样品中碳酸钙的质量分数,进行如下实验:①称取25.0g石灰开佯品,平均分成两份,并分别加工成块状和粉末状; ②将两份样品分别投入两个锥形瓶中,各加入足量的相同溶质质量分数的稀盐酸(样品所含杂质不溶于水也不与酸反应),测得生成二氧化碳的质量与反应时间的关系如图所示:
(2012?乐山二模)某化学兴趣小组为测定一种石灰石样品中碳酸钙的质量分数,进行如下实验:①称取25.0g石灰开佯品,平均分成两份,并分别加工成块状和粉末状; ②将两份样品分别投入两个锥形瓶中,各加入足量的相同溶质质量分数的稀盐酸(样品所含杂质不溶于水也不与酸反应),测得生成二氧化碳的质量与反应时间的关系如图所示: