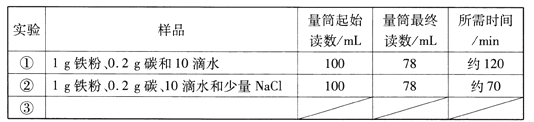
题目内容
【题目】
(1)该铁合金是生铁还是钢?
(2)加入的稀硫酸中溶质的质量分数?
(3)反应后所得溶液中溶质的质量分数?
【答案】(1)钢(2)9.8%(3)14.4%
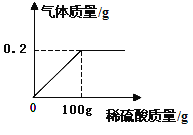
【解析】试题分析:设样品中铁的质量为X,需要硫酸的量为Y,生成硫酸亚铁的质量为Z
Fe + H2SO4="=" Fe SO4+ H2↑
56 98 152 2
X Y Z 0.2克
列比例式得:56:X=98:Y=152:Z=2:0.2克解得:X=5.6克Y=9.8克Z=15.2克
样品中碳的质量分数为:(5.7g-5.6)÷5.7g×100%==1.8% < 2% 该铁合金是钢
加入的稀硫酸中溶质的质量分数:(9.8g÷100g)×100%==9.8%
反应后所得溶液中溶质的质量分数: 15.2g/(5.6g+100g-0.2g)]×100%==14.4%

练习册系列答案
 尖子生新课堂课时作业系列答案
尖子生新课堂课时作业系列答案 英才计划同步课时高效训练系列答案
英才计划同步课时高效训练系列答案
相关题目
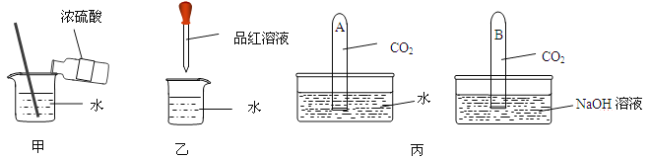
【题目】下列对一些事实的解释错误的是
事 实 | 解 释 | |
A | 书写档案规定必须使用碳素墨水 | 碳的化学性质稳定 |
B | 二氧化碳能使浸有紫色石蕊溶液的纸花变红 | 二氧化碳和水反应生成碳酸 |
C | 焦炭可以把铁从它的氧化物矿石里还原出来 | 焦炭具有氧化性 |
D | 金刚石、石墨和 C60的化学性质相似但物理性质差异很大 | 金刚石、石墨和 C60都是由碳元素组成的单质,但它们的原子排列方式不同 |