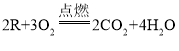题目内容
【题目】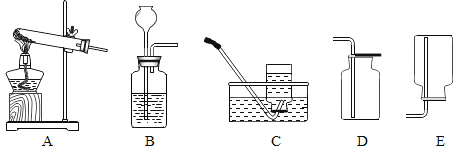
(1)实验室中也常用高锰酸钾加热分解制取氧气。写出它的化学反应方程式(或文字表达式):_____,该反应属于_____反应。
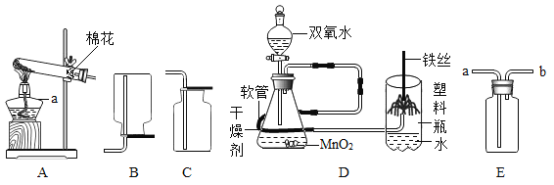
(2)实验室里还会通过分解过氧化氢(H2O2)的方法制取氧气。写出该反应的化学反应方程式或文字表达式______,此时应该选用上图中的________作为发生装置。收集氧气的装置可以用_______。
【答案】2KMnO4 ![]() K2MnO4+MnO2+O2↑ 分解 2H2O2
K2MnO4+MnO2+O2↑ 分解 2H2O2 ![]() 2H2O+O2↑ B C或D
2H2O+O2↑ B C或D
【解析】
(1)高锰酸钾受热分解生成锰酸钾和二氧化锰和氧气,它的化学反应方程式为:2KMnO4 ![]() K2MnO4+MnO2+O2↑,符合多变一,属于分解反应;故填:2KMnO4
K2MnO4+MnO2+O2↑,符合多变一,属于分解反应;故填:2KMnO4 ![]() K2MnO4+MnO2+O2↑;分解。
K2MnO4+MnO2+O2↑;分解。
(2)过氧化氢在二氧化锰的催化作用下生成水和氧气,化学方程式为:2H2O2 ![]() 2H2O+O2↑,该反应的反应物是固体和液体,反应条件是常温,所以应该选用图中的B装置;氧气密度大于空气且不易溶于水,可用向上排空气法和排水法收集;故填:2H2O2
2H2O+O2↑,该反应的反应物是固体和液体,反应条件是常温,所以应该选用图中的B装置;氧气密度大于空气且不易溶于水,可用向上排空气法和排水法收集;故填:2H2O2 ![]() 2H2O+O2↑;B;C或D。
2H2O+O2↑;B;C或D。

 学练快车道快乐假期暑假作业新疆人民出版社系列答案
学练快车道快乐假期暑假作业新疆人民出版社系列答案 浙大优学小学年级衔接导与练浙江大学出版社系列答案
浙大优学小学年级衔接导与练浙江大学出版社系列答案 小学暑假作业东南大学出版社系列答案
小学暑假作业东南大学出版社系列答案 津桥教育暑假拔高衔接广东人民出版社系列答案
津桥教育暑假拔高衔接广东人民出版社系列答案 波波熊暑假作业江西人民出版社系列答案
波波熊暑假作业江西人民出版社系列答案【题目】某兴趣小组用如图所示装置制取氧气,试管中固体的质量随时间变化的数据见下表。制取结束后,将剩余固体用适量水充分溶解后,过滤,回收二氧化锰固体,并得到氯化钾溶液100g。
加热时间/min | 0 | t1 | t2 | t3 |
固体质量/g | 28.0 | 23.2 | 18.4 | 18.4 |
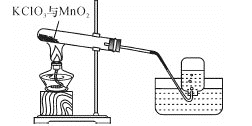
(1)共制得氧气_________g。
(2)计算所得氯化钾溶液的溶质质量分数_________。
【题目】通过联想提出问题是探究的源泉,某合作学习小组开展了如下探究,请你协助他们完成:
(提出问题)温度越高,分子运动越快;温度越高,化学反应也越快吗?
(实验探究)为了探究温度对H2O2分解反应速率的影响,某实验小组使用如图所示实验装置(夹持装置略去),进行了两次实验,两次实验的部分数据如表所示:
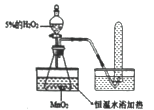
实验1 | 实验2 | |
MnO2的质量/g | 0.5 | 0.5 |
5%的H2O2的体积/mL | 40 | X |
恒温水浴加热/℃ | 40 | 80 |
收集一试管氧气所需要时间/秒 | 36 | 23 |
(1)在这两个实验中,收集氧气采用的方法是_________。
(2)实验2中X=_______。
(3)上述实验中所发生的文字表达式为______________,属于________反应。
(实验结论)通过两次实验的实验记录,你可以得出的实验结论是______________;
(实验拓展)请根据所学再举出一例与温度有关的实验结论:温度越高,__________。