题目内容
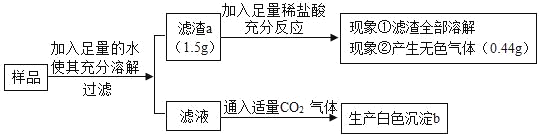
【题目】有一包白色固体样品,可能由硫酸钠、氯化钠、氢氧化钠、碳酸钙、氯化钡、氯化镁中的一种或几种物质组成,为探究该样品的组成,某小组取适量样品按下列流程进行实验。
请回答下列问题:
(1)滤渣a的成分是_____,滤液中滴加酚酞呈_____色,沉淀b为_____,滤液中溶质的成分为_____。
(2)根据上述实验,原固体中一定存在是物质有_____。
(3)若现象①“滤渣全部溶解”变为“滤渣部分溶解”,其他现象不变,则原样品中不能确定是否存在的物质是_____
【答案】碳酸钙和氢氧化镁 红 碳酸钡 氯化钠、氢氧化钠和氯化钡 碳酸钙、氢氧化钠、氯化镁、氯化钡 氯化镁和氯化钠
【解析】
(1)根据题目给出的流程图和信息:样品中加入足量的水充分溶解、过滤,滤渣全部溶解,说明滤渣中一定没有硫酸钡;1.5g滤渣a中加入稀盐酸充分反应,生成0.44g气体,说明滤渣a中一定有碳酸钙和氢氧化镁,因为产生0.44g二氧化碳气体,需要碳酸钙的质量是1g,说明样品中一定有碳酸钙、氢氧化钠和氯化镁;滤液中一定有氯化钠,在滤液中通入二氧化碳生成白色沉淀b碳酸钡,说明滤液中一定有氢氧化钠和氯化钡,因此滤液中滴加酚酞呈红色;
(2)样品中加入足量的水充分溶解、过滤,滤渣全部溶解,说明滤渣中一定没有硫酸钡;1.5g滤渣a中加入稀盐酸充分反应,生成0.44g气体,说明滤渣a中一定有碳酸钙和氢氧化镁,因为产生0.44g二氧化碳气体,需要碳酸钙的质量是1g,说明样品中一定有碳酸钙、氢氧化钠和氯化镁;在滤液中通入二氧化碳生成白色沉淀b碳酸钡,说明样品中一定有氯化钡;(3)若现象①“滤渣全部溶解”变为“滤渣部分溶解”,其他现象不变,则原样品中不能确定是否存在的物质是氯化镁和氯化钠。

 天天向上一本好卷系列答案
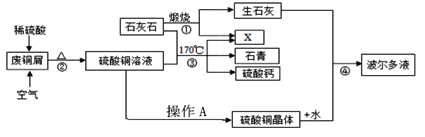
天天向上一本好卷系列答案【题目】某化工厂用石灰石和铜屑等设计生产石青、波尔多液的工艺流程如下:
查阅资料:硫酸铜的溶解度如下表:
温度/℃ | 0 | 10 | 20 | 30 | 40 | 50 | 60 | 80 | 100 |
溶解度/g | 14.3 | 17.4 | 20.7 | 25.0 | 28.5 | 33.3 | 40.0 | 55.0 | 75.4 |
(产品制备)
(1)流程图中X的化学式______
(2)反应②在80℃条件下制备硫酸铜,其化学方程式为_______。操作A将CuSO4溶液进行蒸发浓缩、________、过滤、洗涤等操作即得到硫酸铜晶体。
(组成测定)
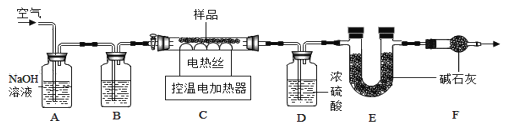
小组同学为测定石青的组成,称取了一定质量的石青样品,用如图装置进行实验。
查阅资料:
①石青的化学式可表示为aCuCO3b Cu(OH)2
②Cu(OH)2在66℃~68℃完全分解:Cu(OH)2![]() CuO+H2O; CuCO3在200℃~220℃完全分解:CuCO3
CuO+H2O; CuCO3在200℃~220℃完全分解:CuCO3![]() CuO+CO2↑
CuO+CO2↑
③ CuSO4固体为白色,CuSO45H2O固体为蓝色
实验步骤:①连接仪器,并_________, 准确称取69.2g aCuCO3bCu(OH)2放在C装置中;②打开活塞鼓入一段时间空气,称量装置D、E的质量;③关闭活塞,控制C装置中的温度为250℃对石青进行热分解,直至C装置中剩余固体质量不再变化为止;④打开活塞,_______;⑤冷却后,称量,装置D增重3.6g,装置
(3)完善上述实验步骤中的填空:①_______;④_____________。
(4)洗气瓶A中氢氧化钠溶液的作用是______;B中所装液体为____(填名称)。
(5)试确定石青的化学式______(请写出计算过程)。
(6)若缺少F装置,测得的a:b的值将________(选填“偏大”、“偏小”、“不变”)。
(脱水探究)
硫酸铜晶体受热会逐步失去结晶水。取纯净的CuSO45H2O固体2.50g,放在上图实验装置C中进行加热,测定固体质量随温度的变化情况如图所示。
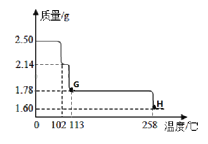
(7)G点固体的化学式是________;H点固体的颜色是_______。
(8)将CuSO45H2O固体加热到570℃分解后,得到的主要产物是黑色粉末、硫的一种氧化物和水蒸气,该反应的化学方程式为:_________。