题目内容
【题目】某固体粉末可能含有碳酸钙、氧化铜、氧化铁、木炭粉中的几种,取mg该固体粉末按下列流程进行实验(本流程涉及到的反应均为初中化学常见的反应,且各步均恰好完全反应)。
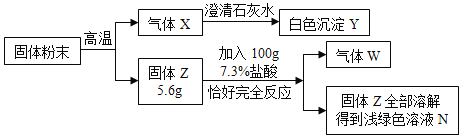
(1)白色沉淀Y是_______________
(2)原固体中一定有________________________________________
(3)溶液N中溶质的组成可能是____________________________________________
【答案】CaCO3或碳酸钙 氧化铁和木炭粉 FeCl2、FeCl2和CaCl2
【解析】
根据碳酸钙在高温的条件下生成氧化钙和二氧化碳,木炭和氧化铜在高温的条件下生成铜和二氧化碳,木炭和氧化铁高温生成铁和二氧化碳,铜不会与酸反应,铁和盐酸反应生成浅绿色的氯化亚铁和氢气,氧化钙也会与盐酸反应生成氯化钙等知识进行分析。
(1)因为气体X能使澄清的石灰水变浑浊,二氧化碳能与澄清石灰水中的氢氧化钙反应生成碳酸钙白色沉淀和水,所以X是二氧化碳,Y是碳酸钙(CaCO3)。
(2)因为固体Z5.6g和100g7.3%的盐酸恰好完全反应,生成气体W,固体Z全部溶解得到浅绿色溶液N,而含有亚铁离子的溶液呈浅绿色,所以浅绿色溶液N中有氯化亚铁,故可推出Z中有铁,W是氢气;根据题中转化关系,固体Z是由原固体粉末在高温条件下反应生成,因此原固体粉末中一定有氧化铁和木炭粉;又因为固体Z和盐酸恰好完全反应,固体Z全部溶解,所以固体Z中一定没有铜,因此原固体中一定没有氧化铜;但碳酸钙不能确定是否含有,因为氧化钙和盐酸反应的质量比与铁和盐酸反应的质量比相同,所以该题无法确定原固体中是否含有碳酸钙。故原固体中一定有:氧化铁和木炭粉。
(3)根据(2)中分析,固体Z中一定含有铁,可能含有氧化钙,因此固体Z和盐酸恰好完全反应后,如果固体Z中只含有铁,则所得溶液N中溶质的是:FeCl2;如果固体Z中含有铁和氧化钙,则所得溶液N中溶质的是:FeCl2和CaCl2。