题目内容
建立微观与宏观物质间的联系,是化学学科的特点.请回答下列相关问题:
(1)在氦气、二氧化硅、铜和氯化钠4种物质中,由分子组成的是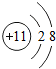
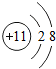 和
和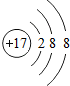
 .
.
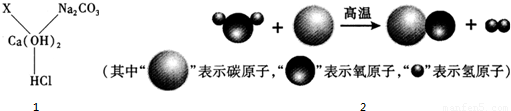
(2)铜锈的主要成分是碱式碳酸铜[Cu2(OH)2CO3],它是由
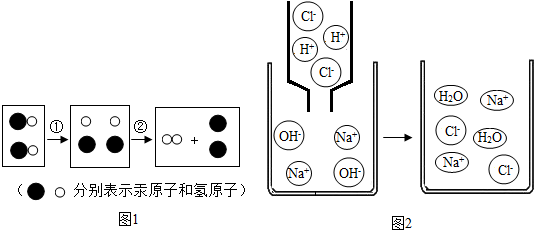
(3)在10%的硫酸溶液中存在着自由移动的微粒是
(1)在氦气、二氧化硅、铜和氯化钠4种物质中,由分子组成的是
SiO2
SiO2
;由离子组成的是NaCl
NaCl
(写化学式),其阳离子和阴离子的结构简图分别是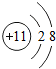
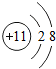


(2)铜锈的主要成分是碱式碳酸铜[Cu2(OH)2CO3],它是由
4
4
种元素组成的,据此分析铜生锈除铜外,还需要哪几种物质参与反应O2、CO2、H2O
O2、CO2、H2O
,反应的化学方程式是2Cu+O2+CO2+H2O═Cu2(OH)2CO3
2Cu+O2+CO2+H2O═Cu2(OH)2CO3
.(3)在10%的硫酸溶液中存在着自由移动的微粒是
SO42-、H+、H2O
SO42-、H+、H2O
(填微粒符号),它能和10%的氢氧化钠溶液发生复分解
复分解
反应(填基本化学反应类型).反应过程中不断减少的微粒是H+、OH-
H+、OH-
(填微粒符号).两种溶液中溶质的化学计量数之比为1:2
1:2
时,两者恰好完全反应.分析:(1)根据物质的构成及离子结构示意图的写法分析解答;
(2)要从根据碱式碳酸铜的组成元素和铜发生锈蚀的环境考虑,根据质量守恒定律,元素的种类不变分析反应物,并书写方程式;
(3)硫酸溶液中存在自由移动的氢离子、硫酸根离子、水分子,酸和碱可发生复分解反应,实质是氢离子和氢氧根离子结合生成水,并结合方程式分析解答.
(2)要从根据碱式碳酸铜的组成元素和铜发生锈蚀的环境考虑,根据质量守恒定律,元素的种类不变分析反应物,并书写方程式;
(3)硫酸溶液中存在自由移动的氢离子、硫酸根离子、水分子,酸和碱可发生复分解反应,实质是氢离子和氢氧根离子结合生成水,并结合方程式分析解答.
解答:解:(1)在氦气、二氧化硅、铜和氯化钠4种物质中,由分子组成的是二氧化硅,金属和稀有气体由原子构成,离子组成的是氯化钠,钠原子失去一个电子变为钠离子,氯原子得到一个电子变为氯离子,结构简图如下;
(2)碱式碳酸铜中含有碳,氢,氧,铜四种元素,根据质量守恒定律,反应物中也应该含有这四种元素,除了铜外,还需要氧气,空气中含有碳和氢的物质就是水和二氧化碳,反应的方程式是:2Cu+O2+CO2+H2O═Cu2(OH)2CO3;
(3)在10%的硫酸溶液中存在着自由移动的微粒是氢离子、硫酸根离子、水分子,酸和碱可发生复分解反应,实质是氢离子和氢氧根离子结合生成水,所以溶液中的氢离子和氢氧根离子将逐渐减少;氢氧化钠和硫酸反应的方程式是H2SO4+2NaOH═Na2SO4+2H2O,由方程式可知,硫酸和氢氧化钠溶液中溶质的化学计量数之比是1:2时二者恰好完全反应;
故答案为:(1)SiO2;NaCl;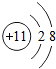 ;
; ;
;
(2)4;O2、CO2、H2O;2Cu+O2+CO2+H2O═Cu2(OH)2CO3;
(3)SO42-、H+、H2O;复分解;H+、OH-;1:2或2:1.
(2)碱式碳酸铜中含有碳,氢,氧,铜四种元素,根据质量守恒定律,反应物中也应该含有这四种元素,除了铜外,还需要氧气,空气中含有碳和氢的物质就是水和二氧化碳,反应的方程式是:2Cu+O2+CO2+H2O═Cu2(OH)2CO3;
(3)在10%的硫酸溶液中存在着自由移动的微粒是氢离子、硫酸根离子、水分子,酸和碱可发生复分解反应,实质是氢离子和氢氧根离子结合生成水,所以溶液中的氢离子和氢氧根离子将逐渐减少;氢氧化钠和硫酸反应的方程式是H2SO4+2NaOH═Na2SO4+2H2O,由方程式可知,硫酸和氢氧化钠溶液中溶质的化学计量数之比是1:2时二者恰好完全反应;
故答案为:(1)SiO2;NaCl;
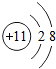 ;
; ;
;(2)4;O2、CO2、H2O;2Cu+O2+CO2+H2O═Cu2(OH)2CO3;
(3)SO42-、H+、H2O;复分解;H+、OH-;1:2或2:1.
点评:本题考查了质量守恒定律的应用,化学方程式的书写等,离子结构示意图的表示方法等知识,难度比较大,要结合题意细心分析解答.

练习册系列答案
相关题目