题目内容
海水是一种重要的自然资源(海水中含NaCl、MgCl2等物质),被誉为“国防金属”的镁主要是从海水中提取的,下面是从海水中提取金属镁的简单流程.

(1)从海水中获得淡水,常用的方法是
(2)从海水中获得粗盐,可将海水进行
(3)试剂A最好选用
(4)写出化学方程式:①

(1)从海水中获得淡水,常用的方法是
蒸馏
蒸馏
;(2)从海水中获得粗盐,可将海水进行
蒸发结晶
蒸发结晶
;(3)试剂A最好选用
熟石灰
熟石灰
(填“熟石灰”或“烧碱”);(4)写出化学方程式:①
MgCl2++Ca(OH)2═Mg(OH)2↓+CaCl2
MgCl2++Ca(OH)2═Mg(OH)2↓+CaCl2
②2HCl+Mg(OH)2=MgCl2+2H2O
2HCl+Mg(OH)2=MgCl2+2H2O
.分析:(1)根据物质沸点的差异,一般常用的方法是利用蒸馏来淡化海水;
(2)根据食盐易溶于水,若从海水中获得食盐,则是可溶性固体与水的分离,可用蒸发结晶的方法可以从海水中获得食盐;
(3)氢氧化钙显碱性,能和氯化镁反应生成氢氧化镁沉淀,且氢氧化钙的价格比较经济,而烧碱的碱性强、价格高;
(4)根据元素守恒和转化中物质化学式的差异来分析所用试剂和发生的化学反应.
(2)根据食盐易溶于水,若从海水中获得食盐,则是可溶性固体与水的分离,可用蒸发结晶的方法可以从海水中获得食盐;
(3)氢氧化钙显碱性,能和氯化镁反应生成氢氧化镁沉淀,且氢氧化钙的价格比较经济,而烧碱的碱性强、价格高;
(4)根据元素守恒和转化中物质化学式的差异来分析所用试剂和发生的化学反应.
解答:解:(1)因盐类物质的沸点比水高,则从海水中获得淡水,可用的方法是蒸馏,故答案为:蒸馏;
(2)从海水中获得粗盐,是可溶性固体与水的分离,则可将海水进行蒸发结晶可得到食盐,故答案为:蒸发结晶;
(3)氢氧化钙显碱性,能和氯化镁反应生成氢氧化镁沉淀,氢氧化钙的价格比烧碱低,碱性弱,则选择熟石灰,故答案为:熟石灰;
(4)因①是MgCl2与熟石灰反应生成氢氧化镁和氯化钙的反应,②中由化学式可以看出氢氧根离子变为氯离子,则所用试剂为盐酸,
该反应是氢氧化镁与盐酸反应生成氯化镁和水,故答案为:MgCl2++Ca(OH)2═Mg(OH)2↓+CaCl2;2HCl+Mg(OH)2=MgCl2+2H2O.
(2)从海水中获得粗盐,是可溶性固体与水的分离,则可将海水进行蒸发结晶可得到食盐,故答案为:蒸发结晶;
(3)氢氧化钙显碱性,能和氯化镁反应生成氢氧化镁沉淀,氢氧化钙的价格比烧碱低,碱性弱,则选择熟石灰,故答案为:熟石灰;
(4)因①是MgCl2与熟石灰反应生成氢氧化镁和氯化钙的反应,②中由化学式可以看出氢氧根离子变为氯离子,则所用试剂为盐酸,
该反应是氢氧化镁与盐酸反应生成氯化镁和水,故答案为:MgCl2++Ca(OH)2═Mg(OH)2↓+CaCl2;2HCl+Mg(OH)2=MgCl2+2H2O.
点评:本题考查从海水中提取镁的流程,学生应注意利用物质的性质、流程中元素守恒等知识来解答,并注意利用所选试剂的经济性、碱性等来判断选择试剂的合理性.

练习册系列答案
 优化作业上海科技文献出版社系列答案
优化作业上海科技文献出版社系列答案
相关题目
 自然界的碳氧循环如图所示是自然界中氧气和二氧化碳的循环简图,请仔细读图回答有关问题:
自然界的碳氧循环如图所示是自然界中氧气和二氧化碳的循环简图,请仔细读图回答有关问题:
 自然界的碳氧循环如图所示是自然界中氧气和二氧化碳的循环简图,请仔细读图回答有关问题:
自然界的碳氧循环如图所示是自然界中氧气和二氧化碳的循环简图,请仔细读图回答有关问题: C6H12O6(葡萄糖)+3O2,生成的葡萄糖供植物生长.则光合作用为植物生长提供的元素有______.
C6H12O6(葡萄糖)+3O2,生成的葡萄糖供植物生长.则光合作用为植物生长提供的元素有______.
 CO2
CO2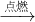 二氧化碳+水
二氧化碳+水 Na 2CO3+H2O+CO2↑
Na 2CO3+H2O+CO2↑