题目内容
(10分)工业上用碳酸钠溶液与石灰水反应制烧碱。对于碳酸钠溶液与石灰水是否恰好完全反应,某化学兴趣小组的同学将其产物进行过滤,并对滤液进行如下探究。
【提出问题】滤液中含有哪些溶质?
【猜想与假设】假设一:滤液中只含氢氧化钠 假设二:滤液中含氢氧化钠和碳酸钠
假设三:滤液中含
假设四:滤液中含氢氧化钠、氢氧化钙和碳酸钠
【进行实验】甲同学设计了如下实验方案:
【反思与评价】
(1)碳酸钠溶液与石灰水反应的基本类型为 。
(2)乙同学认为假设四不合理,理由是 。
(3)丙同学认为甲同学设计方案还不能说明碳酸钠溶液和澄清石灰水恰好完全反应,她的理由是 。
(4)丁同学认为要说明碳酸钠溶液与石灰水是否恰好完全反应,还需在甲同学实验方案的基础上进行实验。她的实验方案是:
【定量研究】
(5)戊同学称取100g烧碱固体样品(样品中的杂质是碳酸钠),
加水溶解得到溶液A,取A溶液的1/5向其中加入CaCl2溶液。
反应时CaCl2溶液与沉淀的质量关系如图所示。
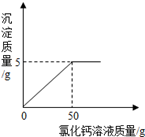
①样品中氢氧化钠的质量为 g;
②计算所加CaCl2溶液中钙离子的质量分数。(写出计算过程)
【提出问题】滤液中含有哪些溶质?
【猜想与假设】假设一:滤液中只含氢氧化钠 假设二:滤液中含氢氧化钠和碳酸钠
假设三:滤液中含
假设四:滤液中含氢氧化钠、氢氧化钙和碳酸钠
【进行实验】甲同学设计了如下实验方案:
| 实验步骤 | 实验现象 | 结论 |
| 取少量滤液放在试管中,再滴入氯化钙溶液 | 若生成白色沉淀 | 碳酸钠过量 |
| 若无明显现象 | 恰好反应 |
(1)碳酸钠溶液与石灰水反应的基本类型为 。
(2)乙同学认为假设四不合理,理由是 。
(3)丙同学认为甲同学设计方案还不能说明碳酸钠溶液和澄清石灰水恰好完全反应,她的理由是 。
(4)丁同学认为要说明碳酸钠溶液与石灰水是否恰好完全反应,还需在甲同学实验方案的基础上进行实验。她的实验方案是:
| 实验步骤 | 实验现象和结论 |
| | |
| |
(5)戊同学称取100g烧碱固体样品(样品中的杂质是碳酸钠),
加水溶解得到溶液A,取A溶液的1/5向其中加入CaCl2溶液。
反应时CaCl2溶液与沉淀的质量关系如图所示。

①样品中氢氧化钠的质量为 g;
②计算所加CaCl2溶液中钙离子的质量分数。(写出计算过程)
【猜想与假设】假设三: 氢氧化钠和氢氧化钙
【反思与评价】(1)复分解反应 (2)因为氢氧化钙溶液与碳酸钠溶液不能共存
(3)若氢氧化钙过量,滴加氯化钙溶液也无明显现象
(4)
【定量研究】(5)①73.5 ② 4%
【反思与评价】(1)复分解反应 (2)因为氢氧化钙溶液与碳酸钠溶液不能共存
(3)若氢氧化钙过量,滴加氯化钙溶液也无明显现象
(4)
| 实 验 步 骤 | 实 验 现 象 和 结 论 |
| 取少量甲同学实验用的原滤液放在试管中,在通入足量的二氧化碳(或滴入Na2CO3溶液),观察 | 溶液无变化,则不含氢氧化钙 |
| 溶液变浑浊,则含氢氧化钙 |
试题分析:【猜想与假设】反应后的滤液,既要考虑生成物,还要考虑反应物是否过量,故假设三: 氢氧化钠和氢氧化钙
【反思与评价】(1)碳酸钠溶液与石灰水反应的方程式:Ca(OH)2+Na2CO3==CaCO3↓+2NaOH,基本类型属于复分解反应
(2)乙同学认为假设四不合理,理由是:因为氢氧化钙溶液与碳酸钠溶液会相互反应,不能共存
(3)丙同学认为甲同学设计方案还不能说明碳酸钠溶液和澄清石灰水恰好完全反应,她的理由是:若氢氧化钙过量,滴加氯化钙溶液也无明显现象
(4)丁同学认为要说明碳酸钠溶液与石灰水是否恰好完全反应,还需在甲同学实验方案的基础上进行实验。她的实验方案是
| 实 验 步 骤 | 实 验 现 象 和 结 论 |
| 取少量甲同学实验用的原滤液放在试管中,在通入足量的二氧化碳(或滴入Na2CO3溶液),观察 | 溶液无变化,则不含氢氧化钙 |
| 溶液变浑浊,则含氢氧化钙 |
解:设Na2CO3的质量为x,CaCl2质量为y
CaCl2+Na2CO3==CaCO3↓+2NaCl
106 100
Y X 5g
106:100=x:5g
X=5.3g
(1)由于是取A溶液的1/5,根据溶液的均一性,故原溶液A中含有的Na2CO3的质量=5×5.3g=26.5g,故100g烧碱固体样品中氢氧化钠的质量=100g-26.5g=73.5g
(2)111:100=y:5g y=5.55g
故钙元素质量=5.55g×40/111×100%=2g
所以所加CaCl2溶液中钙离子的质量分数=2g/50g×100%=4%

练习册系列答案
相关题目


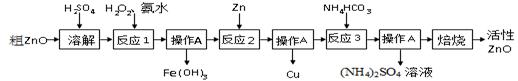
 ZnO+CO2↑ Zn(OH)2
ZnO+CO2↑ Zn(OH)2