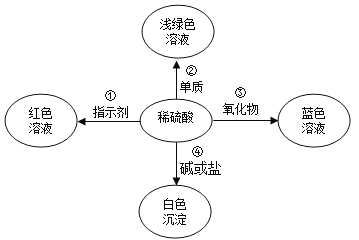
题目内容
【题目】海水晒制可得粗盐,粗盐除NaCl 外,还含有CaCl2、NaSO4以及泥沙等杂质。现设计一种制备精盐的实验流程,步骤如下。

①实验流程中加入过量x、y溶液中的溶质分别是_______。
| Ⅰ | Ⅱ | Ⅲ | Ⅳ |
X | Na2CO3 | Na2CO3 | BaCl2 | Ba(NO3)2 |
Y | BaCl2 | Ba(NO3)2 | Na2CO3 | Na2CO3 |
请简述选择该选项的理由__________。
②判断Y溶液过量的方法是__________。
I 取少量溶液A滴入硝酸银溶液,出现白色沉淀
II 取少量沉淀滴入盐酸,有气泡产生
III 取少量溶液A,滴入紫色石蕊,溶液变蓝
IV 取少量溶液A滴入石灰水,出现白色沉淀
③沉淀中除了泥沙等难溶杂质,还主要有_________物质。加入Z溶液过量,但对精盐制备没有影响不必除去,这是利用Z溶液的_______性质。
【答案】III 可以除去杂质Na2SO4、 CaCl2,并除去了过量的BaCl2 III 、IV BaCO3、BaSO4、CaCO3 易挥发
【解析】
①I、要除去杂质Na2SO4、CaCl2,先加过量Na2CO3溶液,碳酸钠和氯化钙反应生成碳酸钙沉淀和氯化钠,再加过量BaCl2溶液,氯化钡分别和硫酸钠、碳酸钠反应生成硫酸钡沉淀、碳酸钡沉淀和氯化钠,会剩余氯化钡,故引入新杂质BaCl2,故错误;
II、要除去杂质Na2SO4、CaCl2,先加过量Na2CO3溶液,碳酸钠和氯化钙反应生成碳酸钙沉淀和氯化钠,再加过量Ba(NO3)2溶液,硝酸钡分别和硫酸钠、碳酸钠反应生成硫酸钡沉淀、碳酸钡沉淀和硝酸钠,会生成新的杂质硝酸钠和硝酸钡,故错误;
III、要除去杂质Na2SO4、CaCl2,先加过量BaCl2溶液,氯化钡和硫酸钠反应生成硫酸钡沉淀和氯化钠,再加过量Na2CO3溶液,碳酸钠分别和氯化钙、氯化钡反应生成碳酸钙沉淀、碳酸钡沉淀和氯化钠,达到除杂目的,故正确;
IV、要除去杂质Na2SO4、CaCl2,先加过量Ba(NO3)2溶液,硝酸钡和硫酸钠反应生成硫酸钡沉淀和硝酸钠,再加过量Na2CO3溶液,碳酸钠分别和硝酸钡、氯化钙反应生成碳酸钡沉淀、碳酸钙沉淀和氯化钠,以及新的杂质硝酸钠,故错误;
故选Ⅲ;
理由是:可以除去杂质Na2SO4、 CaCl2,并除去了过量的BaCl2;
②由①可知Y溶液是Na2CO3溶液;
I 、A中的氯化钠也能和硝酸银溶液反应生成氯化银白色沉淀,故错误;
II、 加入适量Na2CO3溶液,也会生成BaCO3、CaCO3,取少量沉淀滴入盐酸,也会有气泡产生,故错误;
III、 氯化钠溶液显中性,碳酸钠溶液显碱性,所以取少量溶液A,滴入紫色石蕊,若溶液变蓝,说明碳酸钠溶液过量,故正确;
IV、氯化钠和氢氧化钙不反应,碳酸钠和氢氧化钙反应生成碳酸钙沉淀和氢氧化钠,所以取少量溶液A滴入石灰水,若出现白色沉淀,说明碳酸钠溶液过量,故正确;
故选Ⅲ、Ⅳ;
③先加过量BaCl2溶液,氯化钡和硫酸钠反应生成硫酸钡沉淀和氯化钠,再加过量Na2CO3溶液,碳酸钠分别和氯化钙、氯化钡反应生成碳酸钙沉淀、碳酸钡沉淀和氯化钠;溶液A是氯化钠和碳酸钠的混合溶液,要得到纯净的氯化钠,可加入过量稀盐酸将碳酸钠出去,盐酸具有挥发性,蒸发过程中会变成气体跑到空气中,故填:BaCO3、BaSO4、CaCO3、易挥发。

【题目】利用表中装置进行下列实验。已知:白磷的着火点为40℃。
实验装置 | 实验步骤 |
| Ⅰ.集气瓶的容积为250mL,实验开始前在集气瓶内加入50mL蒸馏水;在燃烧匙内加入足量白磷,塞紧瓶塞;取下注射器,吸入足量的、红颜色的水,再连接好装置。 Ⅱ.将组装好的实验装置转移到80℃热水中浸泡,片刻后白磷燃烧。 Ⅲ.待白磷熄灭后,再将整套装置放入冷水中冷却至室温。 |
(1)组装仪器后,用手向上拉动注射器活塞。松开手后,观察到________________,说明此装置气密性良好。
(2)冷却后进入集气瓶的红颜色的水的体积是_____mL。
(3)若在以上实验过程中,同时完成“验证可燃物燃烧需要满足温度达到着火点的条件”,还需补充的实验操作及现象是_______________________。
【题目】如图所示,将液体X加入到集气瓶中与固体Y作用,观察到气球逐渐变大,如表中液体X和固体Y的组合,符合题意的是( )
① | ② | ③ | ④ | ⑤ | |
X | 稀盐酸 | 水 | 水 | 双氧水 | 水 |
Y | 铁粉 | 氢氧化钠 | 氯化钠 | 二氧化锰 | 硝酸铵 |
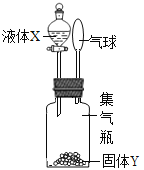
A. ①②⑤ B. ①③④ C. ①②④ D. ②③⑤