题目内容
某氯化钙中含有碳酸钙杂质,称取研细的该样品12.4g放入锥形瓶中,加入32.6g水,充分振荡形成悬浊液,再向锥形瓶中逐滴滴加盐酸使其充分反应至无气泡产生,测得加入盐酸的质量与锥形瓶中物质的质量关系如下表所示,试计算:
加入盐酸的质量/g | 0 | 36.5 |
锥形瓶中物质的质量/g | 45 | 79.3 |
(1)反应产生二氧化碳的质量为_____。
(2)试计算所用稀盐酸的溶质质量分数_____。
 名校课堂系列答案
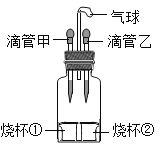
名校课堂系列答案某实验小组用石墨做电极进行电解水实验,为增加导电性,改用Ca(OH)2饱和溶液进行电解,实验时除两个电极均有气泡冒出外,溶液中还出现了白色浑浊,该小组对白色浑浊出现的原因进行了如下探究。
(猜想与假设)
①溶液温度升高导致Ca(OH)2析出而出现白色浑浊。
②水减少导致Ca(OH)2析出而出现白色浑浊。
③与石墨电极有关。
(查阅资料)
①Ca(OH)2的溶解度:20℃时为0.16g,100℃时为0.07g。
②在加热条件下铜能与氧气反应生成黑色的氧化铜。铜与稀硫酸不反应;氧化铜能与稀硫酸反应。
(进行实验)
实验 | 实验装置 | 主要实验操作 | 实验现象 |
1 | ﹣﹣ | 取20mLCa(OH)2 饱和溶液加热至沸腾 | 溶液中未出现白色浑浊 |
2 |
| 取Ca(OH)2饱和溶液于烧杯中,加5ml水,通电3min | 烧杯中溶液体积几乎无明显变化,溶液中明显出现白色浑浊 |
3 | 更换石墨电极为铜电极,取Ca(OH)2 饱和溶液于烧杯中,通电3min | 与电源正极相连的铜电极变黑,溶液中未出现白色浑浊 |
(解释与结论)
(1)实验1得出的结论是_____。
(2)实验2通电3min后得到的溶液为_____(填“饱和”或“不饱和”)溶液。
(3)猜想与假设②不成立,依据的现象是_____。
(4)实验3中更换石墨电极为铜电极的目的是_____。
(反思与评价)
(5)为除去实验3中铜电极上的黑色物质,需要的试剂是_____。
(6)通过探究过程,用石墨做电极进行实验时,Ca(OH)2溶液中出现白色浑浊的原因是_____。