题目内容
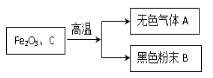
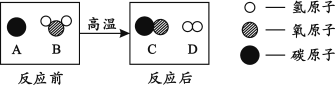
【题目】如图所示,将一定量氧化铜与碳的混合物加热。
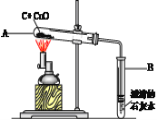
在加热过程中,记录A中固体质量变化如下表,在100秒后停止加热。
加热时间(s) | 0 | 60 | 80 | 90 | 100 |
A中固体质量(g) | 9.6 | 9.6 | 8.6 | 7.4 | 7.4 |
① 0—60秒内固体质量不变,原因是 (12) ,但导管口已有气泡冒出,该气泡是 (13) (填“空气”、“氧气”或“二氧化碳”);实验中说明化学反应发生的现象是 (14) ;选择100秒后停止加热的理由是 (15) 。
② 反应共生成 (16) 克二氧化碳。
③ 计算参加反应的氧化铜的物质的量(请根据化学方程式列式计算)
【答案】①还没有开始反应 空气 A处黑色变成红色或B处变浑浊
固体质量不再改变,碳与氧化铜已经完全反应
② 2.2 ③ 0.1mol
【解析】
试题分析:①由于反应条件是高温,0—60秒内固体质量不变,原因是:还没有开始反应;但导管口已有气泡冒出,该气泡是装置内的空气受热膨胀排出的;实验中说明化学反应发生的现象是:A处黑色变成红色或B处变浑浊;选择100秒后停止加热的理由是:从表中数据可知,90秒~100秒固体质量不再改变,碳与氧化铜已经完全反应
②根据质量守恒定律:化学反应前后,物质的质量不变,反应共生成二氧化碳的质量=9.6g-7.4g=2.2g
③根据化学方程式C +2CuO![]() 2Cu +CO2↑中CuO与CO2的物质的量的关系,即可计算出参加反应的氧化铜的物质的量
2Cu +CO2↑中CuO与CO2的物质的量的关系,即可计算出参加反应的氧化铜的物质的量
解:n(CO2)=2.2g/44g/mol=0.05mol
设氧化铜的物质的量xmol
C +2CuO![]() 2Cu +CO2↑
2Cu +CO2↑
2 1
xmol 0.05mol
2:1= xmol :0.05mol
x =0.1mol

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案【题目】(8分)生活中常遇见铜制品生锈的情况。活动课上,同学们设计实验对铜锈进行了如下探究活动。
探究活动一:验证铜锈的组成
【查阅资料】
① 铜锈为绿色,其主要成分是Cu2(OH)2CO3。
② 白色的硫酸铜粉末遇水能变为蓝色。
③ 碳不与稀硫酸反应。
④ 氧化铜为黑色固体,能与稀硫酸反应生成硫酸铜溶液。
【进行实验1】
同学们设计了下图所示装置并进行实验。
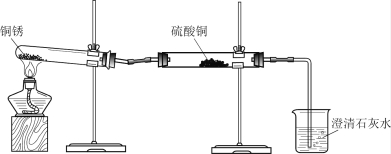
实验操作 | 实验现象 | 实验结论 |
① 按上图组装仪器,装入药品。 ② 加热铜锈,直至不再有气体产生,停止加热。 | 绿色固体变为黑色;硫酸铜粉末变为蓝色;烧杯中液体变浑浊。 | 加热铜锈生成的物质有_____;铜锈由_____元素组成;烧杯中发生反应的化学方程式为______。 |
③ 冷却后,向试管中固体加入适量稀硫酸,稍加热。 | 黑色固体溶解,溶液变为蓝色。 |
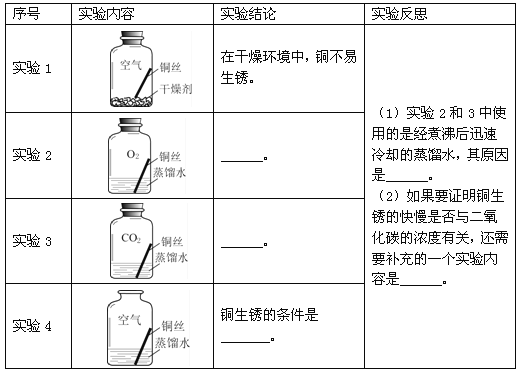
探究活动二:探究铜生锈的条件
【进行实验2】
同学们进行了下面的4个实验,每天观察一次现象,一段时间后,发现只有实验4中的铜丝生锈了,且与水接触的部分生锈更明显。