题目内容
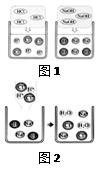
(11分) 在高效复习课堂中,同学们利用“硫酸、硝酸钡、氢氧化钠、碳酸钾” 四种物质的溶液对 “复分解反应发生的条件”进行再探究。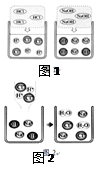
【知识回放】
通过判断上述四种溶液两两之间能否发生反应,我能写出其中符合下列条件的两个化学方程式:
⑴一个中和反应 ① ;
⑵一个有沉淀生成的反应 ② 。
【挖掘实质】
(1)图1是HCl和NaOH在水中解离出离子的示意图,我发现HCl在水中会解离出H+和Cl-,NaOH在水中会解离出Na+和OH-,以此类推硝酸钡在水中会解离出的离子是③ (填离子符号)。
(2)图2是稀盐酸和氢氧化钠溶液发生化学反应的微观过程示意图,该化学反应的实质可以表示为H++ OH-=H2O,我也能用同样的方式表示上述四种溶液两两之间发生反应时有气体生成的反应的实质 ④ 。
(3)通过探究上述四种溶液两两之间是否发生反应的实质,我发现NaOH和H2SO4溶液能发生复分解反应,因为溶液中的H+和OH—不能大量共存; ⑤ 溶液和 ⑥ 溶液也可以发生复分解反应(任写一组物质,下同),因为 ⑦ ; ⑧ 和 ⑨ 溶液不能发生复分解反应,因为 ⑩ (填离子符号,下同)也不能大量共存。
【知识升华】
通过对“复分解反应发生的条件”的再探究,我得出复分解反应发生条件的实质是 11 。
①H2SO4+2NaOH=Na2SO4+2H2O
②H2SO4+Ba(NO3)2=BaSO4↓+2HNO3或K2CO3+
Ba(NO3)2=BaCO3↓+2KNO3
③Ba2+和NO3-或Ba2+和2NO3- ④2H++CO32-=H2O+CO2↑或2H++CO32-=H2CO3,H2CO3=H2O+CO2↑
⑤H2SO4⑥Ba(NO3)2、或⑤K2CO3⑥Ba(NO3)2、或⑤H2SO4⑥K2CO3(写名称也可)
⑦Ba2+和SO42-(或Ba2+和CO32-或H+和CO32-)在溶液中不能大量共存(意义表达准确即可)
⑧NaOH⑨Ba(NO3)2或⑧NaOH⑨K2CO3
⑩K+、CO32—、Na+和OH-(或Na+、OH-、Ba2+和NO3-在溶液中可以大量共存(意义表达准确即可)
11复分解反应的实质是离子交换的反应,只要反应物中某些离子浓度减小了(或不能大量共存),复分解反应就可以发生(意义表达准确即可)
解析