题目内容
(2010?重庆)干燥剂“碱石灰”是氧化钙和氢氧化钠的混合物,在空气中容易变质.某研究小组对一只干燥管里的“碱石灰”样品的成分进行实验探究.【提出猜想】
猜想Ⅰ:没有变质,只含有氧化钙和氢氧化钠.
猜想Ⅱ:部分变质,含有…
猜想Ⅲ:完全变质,只含有碳酸钙、碳酸钠.
【实验探究】
| 操作 | 现象 | 结论 |
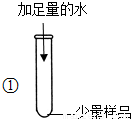 | 试管外壁发烫,得到浑浊的液体. | 推测样品中含有______ |
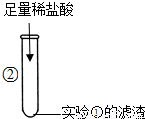 | 滤渣溶解,产生大量气泡. | 写出产生大量气泡的化学方程式: ______ |
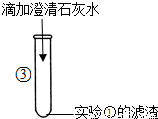 | 产生白色沉淀. | 写出产生白色沉淀的化学方程式: ______ |
(1)从上述实验现象推断:猜想______成立.
(2)“碱石灰”样品里是否一定含有碳酸钙?请说明理由.______.

【答案】分析:【实验探究】①氧化钙、氢氧化钠溶于水都会放出大量的热,因此含有这两种物质的固体溶解时会放出大量热;碳酸钙不溶于水,在溶解时会出现浑浊;
②碳酸钙不溶于水但却可与稀盐酸反应可生成氯化钙、水和气体二氧化碳;
③澄清的石灰水与碳酸钠溶液发生反应,可生成碳酸钙的白色沉淀,同时得到氢氧化钠;
【小结与思考】(1)若固体没有变质只含氢氧化钠和氧化钙,加入足量水溶解时不会出现浑浊;若固体全部变质只含碳酸钙和碳酸钠,加入足量水溶解时则不会出现试管外壁发烫的现象;
(2)若固体不含碳酸钙而是含有碳酸钠和氧化钙,在溶解于足量水中时,碳酸钠与氧化钙遇水生成的氧化钙也可以生成碳酸钙沉淀.
解答:解:【实验探究】①试管外壁发烫说明固体物质溶解时放出大量热,可判断应含有氢氧化钠或氧化钙或两者都含有;加入足量水得到浑浊液体说明固体物质溶解于水时有不溶于水的碳酸钙出现;
故答案为:氢氧化钠(氧化钙和氢氧化钠至少有一个即可)、碳酸钙;
②滤渣碳酸钙与滴入的稀盐酸发生反应,生成氯化钙、水和气体二氧化碳;
故答案为:CaCO3+2HCl=CaCl2+H2O+CO2↑;
③向滤液加入的澄清石灰水变浑浊,说明滤液中一定含有碳酸钠,碳酸钠与石灰水中的氢氧化钙交换成分,生成碳酸钙沉淀和氢氧化钠;
故答案为:Ca(OH)2+Na2CO3=CaCO3↓+2NaOH;
【小结与思考】(1)实验①说明固体中一定含有未变质的氢氧化钠或氧化钙,实验③说明滤液中一定含有变质后形成的碳酸钠,所以可判断碱石灰部分变质;
故答案为:II;
(2)氢氧化钠变质后形成的碳酸钠与未变质的氧化钙遇水形成的氢氧化钙在实验①进行溶解时发生反应,可生成碳酸钙,因此原固体中不含碳酸钙也可以因上述反应而得到滤渣碳酸钙;
故答案为:不一定,若碱石灰中同时有Ca(OH)2和Na2CO3加水后也会得浑浊液体.
点评:本题因固体物质涉及到氢氧化钠、氧化钙、碳酸钠、碳酸钙等,涉及的物质较多而使探究较为复杂;解决时注意抓住主要现象进行分析和推断,逐步深入.
②碳酸钙不溶于水但却可与稀盐酸反应可生成氯化钙、水和气体二氧化碳;
③澄清的石灰水与碳酸钠溶液发生反应,可生成碳酸钙的白色沉淀,同时得到氢氧化钠;
【小结与思考】(1)若固体没有变质只含氢氧化钠和氧化钙,加入足量水溶解时不会出现浑浊;若固体全部变质只含碳酸钙和碳酸钠,加入足量水溶解时则不会出现试管外壁发烫的现象;
(2)若固体不含碳酸钙而是含有碳酸钠和氧化钙,在溶解于足量水中时,碳酸钠与氧化钙遇水生成的氧化钙也可以生成碳酸钙沉淀.
解答:解:【实验探究】①试管外壁发烫说明固体物质溶解时放出大量热,可判断应含有氢氧化钠或氧化钙或两者都含有;加入足量水得到浑浊液体说明固体物质溶解于水时有不溶于水的碳酸钙出现;
故答案为:氢氧化钠(氧化钙和氢氧化钠至少有一个即可)、碳酸钙;
②滤渣碳酸钙与滴入的稀盐酸发生反应,生成氯化钙、水和气体二氧化碳;
故答案为:CaCO3+2HCl=CaCl2+H2O+CO2↑;
③向滤液加入的澄清石灰水变浑浊,说明滤液中一定含有碳酸钠,碳酸钠与石灰水中的氢氧化钙交换成分,生成碳酸钙沉淀和氢氧化钠;
故答案为:Ca(OH)2+Na2CO3=CaCO3↓+2NaOH;
【小结与思考】(1)实验①说明固体中一定含有未变质的氢氧化钠或氧化钙,实验③说明滤液中一定含有变质后形成的碳酸钠,所以可判断碱石灰部分变质;
故答案为:II;
(2)氢氧化钠变质后形成的碳酸钠与未变质的氧化钙遇水形成的氢氧化钙在实验①进行溶解时发生反应,可生成碳酸钙,因此原固体中不含碳酸钙也可以因上述反应而得到滤渣碳酸钙;
故答案为:不一定,若碱石灰中同时有Ca(OH)2和Na2CO3加水后也会得浑浊液体.
点评:本题因固体物质涉及到氢氧化钠、氧化钙、碳酸钠、碳酸钙等,涉及的物质较多而使探究较为复杂;解决时注意抓住主要现象进行分析和推断,逐步深入.

练习册系列答案
 提分百分百检测卷系列答案
提分百分百检测卷系列答案
相关题目
 (2010?重庆)干燥剂“碱石灰”是氧化钙和氢氧化钠的混合物,在空气中容易变质.某研究小组对一只干燥管里的“碱石灰”样品的成分进行实验探究.
(2010?重庆)干燥剂“碱石灰”是氧化钙和氢氧化钠的混合物,在空气中容易变质.某研究小组对一只干燥管里的“碱石灰”样品的成分进行实验探究.

