题目内容
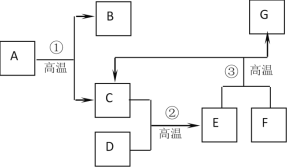
【题目】如图B、C、D、E、F均为含氧元素的物质。(图中“→”表示物质转化关系,部分反应物、生成物及反应条件已略去)。E是单质,其它为化合物。B和D的组成元素相同且D能和血红蛋白结合使人中毒。C和F的组成元素也相同。
(1)用化学用语表示D中氧元素的化合价_____;
(2)B和D化学性质不同的微观原因是_____;
(3)写出C→E的化学反应方程式____,其基本反应类型为____反应。写出D→B化学反应方程式__。
(4)若A是一种常见燃料,则其中除氧元素以外还一定含有的元素是_____。
【答案】CO 分子结构不同 2H2O![]() 2H2↑+O2↑ 分解 2CO+O2
2H2↑+O2↑ 分解 2CO+O2![]() 2CO2或3CO+Fe2O3
2CO2或3CO+Fe2O3![]() 3CO2+2Fe C和H
3CO2+2Fe C和H
【解析】
由于B和D的组成元素相同且D能和血红蛋白结合使人中毒,则D是一氧化碳,B是二氧化碳,再依据C和F的组成元素也相同,且F能生成C,故F是过氧化氢,C是水,E是单质则E是氧气,A能燃烧生成二氧化碳和水,故A中一定含有的元素为碳元素。
由分析可知(1)D是一氧化碳,则D中氧元素的化合价可表示为![]() ;
;
(2)B和D分别是一氧化碳和二氧化碳,依据结构决定性质的知识可知:两者化学性质不同的微观原因是两者的分子结构不同;
(3)C→E是水生成氧气的过程,则该转化的化学反应方程式为:2H2O![]() 2H2↑+O2↑;该反应符合“一变多”的分解反应特点,一氧化碳转化为二氧化碳的过程可以采用其燃烧的方式或与金属氧化物反应,则D→B化学反应方程式为2CO+O2
2H2↑+O2↑;该反应符合“一变多”的分解反应特点,一氧化碳转化为二氧化碳的过程可以采用其燃烧的方式或与金属氧化物反应,则D→B化学反应方程式为2CO+O2![]() 2CO2或3CO+Fe2O3
2CO2或3CO+Fe2O3![]() 3CO2+2Fe;
3CO2+2Fe;
(4)由于A是一种常见燃料,且其燃烧的产物是二氧化碳和水,依据化学反应前后元素的种类不变的特点可知:A中一定含有的元素是碳、氢两种元素。

 云南师大附小一线名师提优作业系列答案
云南师大附小一线名师提优作业系列答案 冲刺100分单元优化练考卷系列答案
冲刺100分单元优化练考卷系列答案【题目】钢铁是重要的金属材料,在工农业生产和生活中应用非常广泛。
I.铁的应用
(1)高科技产品“纳米α-Fe粉”可以用于食品保鲜,称之为“双吸剂”,因为它能吸收空气中的_________。
II.铁的冶炼
工业炼铁的原理是高温下用CO作还原剂,将铁从氧化物中还原出来。请回答下列问题:
(1)写出以赤铁矿为原料,在高温下炼铁的化学方程式:__________________;
(2)高炉炼铁中,焦炭的作用除了可以生成一氧化碳外,还能______________;
Ⅲ.铁的活动性探究
现用一定量的AgNO3和Cu (NO3)2混合溶液,进行了如图所示的实验,并对溶液A和固体B的成分进行了分析和研究.
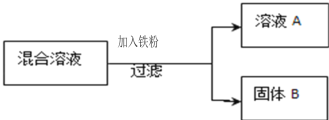
(提出问题)溶液A中的溶质可能有哪些?
(作出猜想)
①只有Fe(NO3)2
②有Fe (NO3)2、Cu (NO3)2
③ 有Fe (NO3)2、AgNO3
④ 有Fe (NO3)2、Cu (NO3)2、AgNO3
(交流讨论)不合理的猜想是__(填标号),其理由是_______
(实验探究)根据如表中的实验步骤及现象,完成表中的实验结论
实验步骤 | 现象 | 实验结论 |
取少量固体B,滴加 稀盐酸 | 有气泡产生 | 溶液A中的溶质成分符合 猜想_____.固体B中的金属成分是________. |
Ⅳ.生铁中铁含量的测定
某课外兴趣小组测定生铁(含杂质的铁,杂质既不溶于水也不溶于酸)中铁的质量分数,他们取五份样品,分别加稀硫酸反应.测得部分数据如下,请根据有关信息回答问题.
实验次数 | 1 | 2 | 3 | 4 | 5 |
取样品质量(g) | 30.0 | 30.0 | 30.0 | 30.0 | 30.0 |
取稀硫酸质量(g) | 50.0 | 100.0 | 150.0 | 200.0 | 250.0 |
产生气体质量(g)/span> | 0.2 | a | 0.6 | 0.8 | 0.9 |
(1)a的数值为______.
(2)列式计算该样品中单质铁的质量分数______.
(3)第5次实验结束后,所得到溶液中溶质的化学式为_______.
(4)第1次实验结束后,所得到溶液中溶质质量分数______?列式计算写过程。