题目内容
下列物质分别加入稀盐酸后有气体放出的是________
A、碳酸氢钠 B、熟石灰 C、铜丝 D、________.
A 锌
分析:根据酸的通性及相关反应的现象来分析作答.常见的酸能与碳酸盐、部分活泼金属反应分别放出二氧化碳和氢气.
解答:能与稀盐酸酸反应放出气体的物质主要有两类:一是碳酸盐,如碳酸钠、碳酸氢钠、碳酸钙等;二是在金属活动性顺序表中排在氢前面的活泼金属.如镁、铁、锌等.
故答案为:A,锌.
点评:活泼金属与酸反应置换出氢气的反应中就特别注意两点:一是活泼金属除钾钙钠之外,二是酸一般指盐酸和稀硫酸.
分析:根据酸的通性及相关反应的现象来分析作答.常见的酸能与碳酸盐、部分活泼金属反应分别放出二氧化碳和氢气.
解答:能与稀盐酸酸反应放出气体的物质主要有两类:一是碳酸盐,如碳酸钠、碳酸氢钠、碳酸钙等;二是在金属活动性顺序表中排在氢前面的活泼金属.如镁、铁、锌等.
故答案为:A,锌.
点评:活泼金属与酸反应置换出氢气的反应中就特别注意两点:一是活泼金属除钾钙钠之外,二是酸一般指盐酸和稀硫酸.

练习册系列答案
相关题目
小军见到一种“化学爆竹”(见下图),只要用手拍打锡纸袋,掷在地上,锡纸袋随后就会突然爆开并伴随响声.他认为,这是锡纸袋中的物质发生化学反应生成气体造成的,于是想探究锡纸袋中的物质成分.

[提出问题]锡纸袋中的物质是什么?
[查阅资料]主要内容如下.
①过氧化氢分解生成氧气,化学方程式为 .
②活泼金属与酸反应生成氢气,例如镁与稀硫酸反应生成氢气,化学方程式为 .
③含有碳酸根或碳酸氢根的盐与酸反应生成二氧化碳.
[猜想与验证]小军打开一个未用过的锡纸袋,内有一小包无色液体和一些白色固体.
(l)猜想:无色液体为酸.
验证:在两支试管中分别加入2mL水和该无色液体,各滴加3滴紫色石蕊试液.紫色石蕊试液遇水不变色,遇该无色液体变红.
实验的初步结论:无色液体为酸.
小军取两支试管进行实验的目的是 .
(2)猜想:白色固体为含有碳酸根或碳酸氢根的盐.
验证:请你运用初中所学知识,帮助小军完成下列实验报告.
小军为进一步验证自己的初步结论,继续查找资料,得到下表.
根据上表数据,该白色固体的检验方法是 .
[反思]通过该探究实验,你还想学习的知识是 .

[提出问题]锡纸袋中的物质是什么?
[查阅资料]主要内容如下.
①过氧化氢分解生成氧气,化学方程式为
②活泼金属与酸反应生成氢气,例如镁与稀硫酸反应生成氢气,化学方程式为
③含有碳酸根或碳酸氢根的盐与酸反应生成二氧化碳.
[猜想与验证]小军打开一个未用过的锡纸袋,内有一小包无色液体和一些白色固体.
(l)猜想:无色液体为酸.
验证:在两支试管中分别加入2mL水和该无色液体,各滴加3滴紫色石蕊试液.紫色石蕊试液遇水不变色,遇该无色液体变红.
实验的初步结论:无色液体为酸.
小军取两支试管进行实验的目的是
(2)猜想:白色固体为含有碳酸根或碳酸氢根的盐.
验证:请你运用初中所学知识,帮助小军完成下列实验报告.
| 主要实验装置 | 主要操作步骤 | 主要实验现象 | 实验操作目的 |
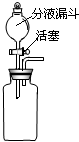 |
在瓶中加入少量白色 固体,再加入适量水,振荡,静置. |
白色固体溶解. | 验证白色固体是否可溶. |
| ①在分液漏斗中加入_______.塞上胶塞,打开活塞,放出适量溶液后,关闭活塞. ②_____________. |
①有大量气体产生. ②_____________ |
验证生成气体的成分. | |
| 实验初步结论:白色固体是可溶性碳酸盐,可能为碳酸钠或碳酸氢钠. | |||
| 温度 | 10℃ | 20℃ | 30℃ | 40℃ |
| 溶解度 | ||||
| 盐 | ||||
| Na2CO3 | 12.5g | 21.5g | 39.7g | 49.0g |
| NaHCO3 | 8.1g | 9.6g | 11.1g | 12.7g |
[反思]通过该探究实验,你还想学习的知识是




 (2013?川汇区三模)酸、碱、盐和氧化物的知识是初中化学重要的基础知识,以下是同学们对相关知识进行探究的过程.
(2013?川汇区三模)酸、碱、盐和氧化物的知识是初中化学重要的基础知识,以下是同学们对相关知识进行探究的过程.