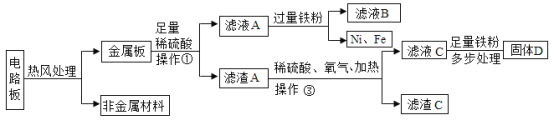
题目内容
【题目】金属材料在生活生产中有着非常广泛的应用。
(1)金属大规模开发利用的先后顺序与下列_____因素有关。
①金属在自然界中的含量 ②金属冶炼的难易程度 ③金属的导电性 ④金属的活泼性
(2)按下图装置连接好仪器(铁架台夹持固定等仪器己略去)检查装置的气密性,往装置中添加药品,打开止水夹K通入含有少量二氧化碳的一氧化碳,一段时间后再点燃酒精喷灯。
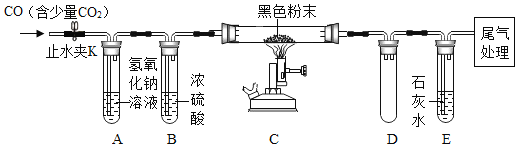
①实验中观察到装置C中固体变为黑色,而装置E中石灰水变浑浊,则硬质玻璃管中发生反应的化学方程式为_____。
②装置D的作用是什么?_____
③实验结束后,请设计合理的实验方案来检验A装置内还含有氢氧化纳,简要写出实验步骤、现象和结论。_____
(3)将6.5g含有一种杂质的锌粉与足量稀硫酸反应,生成0.18g氢气。则该锌粉中混有的杂质是_____(填“铜”或“镁”)。在这种锌粉中加入过量的硝酸银溶液,充分反应后过滤,向溶液加入稀盐酸,有白色沉淀产生。则滤液中含有的溶质是_____(写化学式)。请解释反应后溶液质量减少的原因_____。
(4)某同学将铁粉和铜粉的混合物50g,放入足量的氯化铜溶液中,充分反应后过滤,干燥称得固体质量为54g。求原混合物中铁的质量分数_____。
【答案】②④ 3CO+Fe2O3![]() 3CO2+2Fe 防止石灰水倒流入硬质玻璃管内,使玻璃管炸裂 取实验后A中的溶液少许于试管中加入过量的氯化钡溶液,静止,向上层清澈中加入无色酚酞试液,溶液变红色,说明有氢氧化钠 铜 AgNO3、Cu(NO3)2、Zn(NO3)2 根据化学方程式:Zn+2AgNO3=Zn(NO3)2+2Ag、Cu+2AgNO3=Cu(NO3)2+2Ag可知,每65份质量的锌置换出216份质量的银,每64份质量的铜置换出216份质量的银。生成Cu(NO3)2、Zn(NO3)2的质量小于参加反应的硝酸银的质量 56%
3CO2+2Fe 防止石灰水倒流入硬质玻璃管内,使玻璃管炸裂 取实验后A中的溶液少许于试管中加入过量的氯化钡溶液,静止,向上层清澈中加入无色酚酞试液,溶液变红色,说明有氢氧化钠 铜 AgNO3、Cu(NO3)2、Zn(NO3)2 根据化学方程式:Zn+2AgNO3=Zn(NO3)2+2Ag、Cu+2AgNO3=Cu(NO3)2+2Ag可知,每65份质量的锌置换出216份质量的银,每64份质量的铜置换出216份质量的银。生成Cu(NO3)2、Zn(NO3)2的质量小于参加反应的硝酸银的质量 56%
【解析】
(1)金属大规模开发,利用的先后顺序与金属的活动性和金属冶炼的难易有关,故选②④;
(2)①一氧化碳和氧化铁在高温的条件下生成的铁和二氧化碳,化学方程式为:3CO+Fe2O3![]() 3CO2+2Fe;
3CO2+2Fe;
②装置D的作用是:防止石灰水倒流入硬质玻璃管内,使玻璃管炸裂;
③要想检验实验后的A溶液中含有NaOH,要先除去碳酸钠的干扰,然后再滴加无色酚酞试液检验氢氧根离子的存在,方法如下:取实验后A中的溶液少许于试管中加入过量的氯化钡溶液,静止,向上层清澈中加入无色酚酞试液,溶液变红色,说明有氢氧化钠;
(3)锌、镁和稀硫酸反应的化学方程式及其质量关系为:
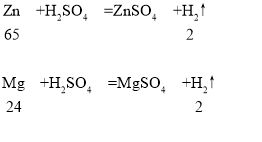
由以上质量关系可知,6.5g锌和稀硫酸完全反应时生成0.2g氢气,如果锌中含有镁时反应生成的氢气质量应该大于0.2g,因此该锌粉中混有的杂质是铜;把这种锌粉放入硝酸银溶液中,锌先和硝酸银反应生成硝酸锌和银,铜后和硝酸银反应生成硝酸铜和银,充分反应后过滤,向溶液加入稀盐酸,有白色沉淀产生,说明滤液中含有硝酸银,锌、铜完全反应,则滤液中含有的溶质是:AgNO3、Cu(NO3)2、Zn(NO3)2;根据化学方程式:Zn+2AgNO3=Zn(NO3)2+2Ag、Cu+2AgNO3=Cu(NO3)2+2Ag可知,每65份质量的锌置换出216份质量的银,每64份质量的铜置换出216份质量的银。生成Cu(NO3)2、Zn(NO3)2的质量小于参加反应的硝酸银的质量;
(4)设原混合物中铁的质量为x。
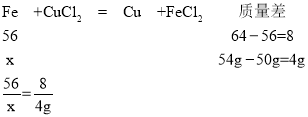
x=28g
原混合物中铁的质量分数为:![]() ×100%=56%
×100%=56%
答:原混合物中铁的质量分数56%。
故答案为:
(1)②④;
(2)①3CO+Fe2O3![]() 3CO2+2Fe;
3CO2+2Fe;
②防止石灰水倒流入硬质玻璃管内,使玻璃管炸裂;
③取实验后A中的溶液少许于试管中加入过量的氯化钡溶液,静止,向上层清澈中加入无色酚酞试液,溶液变红色,说明有氢氧化钠;
(3)铜;AgNO3、Cu(NO3)2、Zn(NO3)2;根据化学方程式:Zn+2AgNO3=Zn(NO3)2+2Ag、Cu+2AgNO3=Cu(NO3)2+2Ag可知,每65份质量的锌置换出216份质量的银,每64份质量的铜置换出216份质量的银。生成Cu(NO3)2、Zn(NO3)2的质量小于参加反应的硝酸银的质量;
(4)56%。

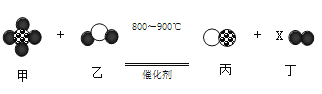
【题目】如图示为某化学反应的微观模拟反应示意图。下列对此物质发生的化学变化的说法中正确的是( )
A.原子分解成质子、中子和电子 | “●”氢原子;“○”氧原子;“ |
B.该化学变化发生的是化合反应 |
|
C.氢元素的化合价没有发生改变 | |
D.反应生成丁粒子的个数X为3 |
A.AB.BC.CD.D
【题目】化学课上,“魅力小组”的四位同学在老师的指导下做制取氢氧化钠溶液的实验。他们向盛有澄清石灰水的烧杯中加入一定量的碳酸钠溶液,观察到生成白色沉淀,过滤后得到无色溶液。向无色溶液中加入稀盐酸,可能发生反应的化学方程式为_____。四位同学对反应后得到的无色溶液中的溶质成分进行了如下探究:
猜想:小红:溶质只有NaOH;
小花:溶质有NaOH、Ca(OH)2、Na2CO3;
小刚:溶质有NaOH、Na2CO3;
小强:溶质有_____。
交流讨论:经过讨论,大家一直认为_____的猜想不正确,理由是_____。
于是他们设计了如下实验方案,继续探究:
进行实验:
实验步骤 | 实验现象 | 实验结论 |
取少量无色溶液于试管中,滴加足量稀盐酸 | _____ | 小刚的猜想不正确 |
取少量无色溶液于试管中,滴加足量Na2CO3溶液 | _____ | 小强的猜想正确 |
反思与评价:在上述实验过程中,要证明小强的猜想正确,还可选择另外一种不同类别的物质_____(填化学式)进行证明。
总结与提升:通过上述实验,四位同学总结出:
(1)反应后溶液中溶质成分中一定有_____;
(2)当设计实验证明反应后溶液中溶质成分时,只需证明可能存在的物质即可。