题目内容
【题目】下面是某化学兴趣小组的同学对氢氧化钠部分性质的探究过程:
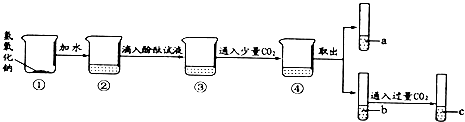
(1)用手触摸②的烧杯外壁,感觉发烫,这是由于氢氧化钠固体溶于水时会_________(填“吸热”或“放热”),该溶液呈色;③中的溶液显色.
(2)从③到④溶液的颜色变化不明显,说明④中的溶液呈_________性(填“酸”或“碱”).
(3)c溶液和a溶液对比,c溶液颜色更浅.
【提出问题】为什么继续通入过量的二氧化碳气体溶液颜色会更浅?
【查阅资料】(1)Na2CO3+CO2+H2O==2NaHCO3(2)Ca(NO3)2溶液与NaHCO3溶液不反应
【设计实验】
实验操作 | 实验现象 | 实验结论 | |
甲 | 取少量c溶液滴入稀盐酸 | __________________ | 溶液中含较多的CO32﹣或HCO3﹣ |
乙 | 另取少量c溶液滴入硝酸钙溶液 | 无明显现象 | 溶液中没有大量的离子 |
【实验结论】根据甲、乙两个实验得出的结论,写出甲实验中发生反应的化学方程式:__________________
【实验反思】同种反应物在不同的条件下发生化学反应时,可能得到不同的产物.如:碳在氧气中燃烧可以生成或_________.
【答案】(1)放热无红(2)碱性(3)【设计实验】产生气泡碳酸根
【实验结论】NaHCO3+HCl=NaCl+H2O+CO2↑【实验反思】二氧化碳一氧化碳
【解析】
试题分析:(1)用手触摸②的烧杯外壁,感觉发烫,这是由于氢氧化钠固体溶于水时会放热,该溶液呈无色;溶液显碱性,能使无色酚酞溶液变红,故③中的溶液显红色
(2)从③到④无色酚酞溶液溶液的颜色变化不明显,说明④中的溶液呈碱性
(3)【设计实验】甲:根据碳酸根离子和碳酸氢根离子都能与稀盐酸反应产生二氧化碳气体,故取少量c溶液滴入稀盐酸,实验现象:产生气泡,实验结论:溶液中含较多的CO32﹣或HCO3﹣
乙:另取少量c溶液滴入硝酸钙溶液,无明显现象,说明溶液中没有大量的碳酸根离子,因为碳酸根离子会与钙离子相互结合形成碳酸钙沉淀
【实验结论】根据甲、乙两个实验得出的结论,排除存在碳酸钠,说明是碳酸氢钠,故甲实验中发生反应的化学方程式为:NaHCO3+HCl=NaCl+H2O+CO2↑
【实验反思】同种反应物在不同的条件下发生化学反应时,可能得到不同的产物.如:碳在氧气中充分燃烧可以生成二氧化碳,不充分燃烧生成一氧化碳