题目内容
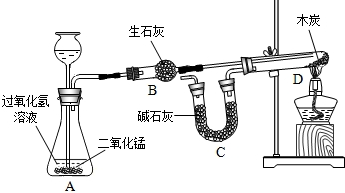
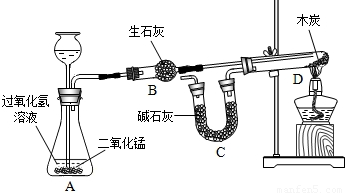
某化学兴趣小组完成了如图所示的化学实验(装置气密性良好),证明了二氧化碳的组成.

探究过程如下:I.称量装有干燥块状木炭的试管D,质量为50.7g,装有碱石灰的干燥管质量为112.3g,连接A、B、D装置;
II.从从长颈漏斗中加入3%的过氧化氢溶液,连接C装置,点燃酒精灯;
III.待D中发生反应,熄灭酒精灯,冷却;
IV.称量试管D及剩余固体质量为50.1g,装置C的质量为114.5g.
已知:碱石灰主要成分是氧化钙和氢氧化钠,木炭中的杂质不参加反应,B、C中所装药品是足量的能够完全吸收相关物质.请回答下列问题:
(1)装置A中发生反应的化学方程式为______,该反应属于______反应;
(2)酒精灯的作用是______;
(3)为减少误差,步骤III冷却过程中需要注意的问题是______;
(4)根据实验数据计算参加反应的氧气质量为______(列示并计算计算结果);从而计算出二氧化碳中碳、氧元素质量之比.
解:(1)装置A中发生反应的化学方程式为:2H2O2 2H2O+O2↑,反应物是一种,生成物是两种,属于分解反应.
2H2O+O2↑,反应物是一种,生成物是两种,属于分解反应.
故填:2H2O2 2H2O+O2↑;分解.
2H2O+O2↑;分解.
(2)酒精灯给木炭加热,当温度达到木炭的着火点时,木炭燃烧起来.
故填:点燃木炭.
(3)为减少误差,步骤III冷却过程中,应该继续通入氧气,使生成的二氧化碳完全进入装置C中,被碱石灰吸收.
故填:继续通氧气.
(4)装置C中两次质量之差就是生成的二氧化碳的质量,二氧化碳的质量为:114.5g-112.3g,
装置D中两次质量之差就是参加反应的木炭的质量,参加反应的木炭的质量为:50.7g-50.1g,
根据质量守恒定律,参加反应的木炭的质量和氧气的质量之和等于生成的二氧化碳的质量,
所以参加反应的氧气的质量为:(114.5g-112.3g)-(50.7g-50.1g)=1.6g.
故填:(114.5g-112.3g)-(50.7g-50.1g)=1.6g.
分析:过氧化氢在二氧化锰的催化作用下,分解生成水和氧气;
酒精灯是常用的一种热源;
为了减少误差,反应生成的二氧化碳应该尽可能地被碱石灰吸收;
根据质量守恒定律可以计算参加反应的氧气质量.
点评:书写化学方程式时要注意规范性,求反应的氧气质量时,运用质量守恒定律是计算的关键.
 2H2O+O2↑,反应物是一种,生成物是两种,属于分解反应.
2H2O+O2↑,反应物是一种,生成物是两种,属于分解反应.故填:2H2O2
 2H2O+O2↑;分解.
2H2O+O2↑;分解.(2)酒精灯给木炭加热,当温度达到木炭的着火点时,木炭燃烧起来.
故填:点燃木炭.
(3)为减少误差,步骤III冷却过程中,应该继续通入氧气,使生成的二氧化碳完全进入装置C中,被碱石灰吸收.
故填:继续通氧气.
(4)装置C中两次质量之差就是生成的二氧化碳的质量,二氧化碳的质量为:114.5g-112.3g,
装置D中两次质量之差就是参加反应的木炭的质量,参加反应的木炭的质量为:50.7g-50.1g,
根据质量守恒定律,参加反应的木炭的质量和氧气的质量之和等于生成的二氧化碳的质量,
所以参加反应的氧气的质量为:(114.5g-112.3g)-(50.7g-50.1g)=1.6g.
故填:(114.5g-112.3g)-(50.7g-50.1g)=1.6g.
分析:过氧化氢在二氧化锰的催化作用下,分解生成水和氧气;
酒精灯是常用的一种热源;
为了减少误差,反应生成的二氧化碳应该尽可能地被碱石灰吸收;
根据质量守恒定律可以计算参加反应的氧气质量.
点评:书写化学方程式时要注意规范性,求反应的氧气质量时,运用质量守恒定律是计算的关键.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目