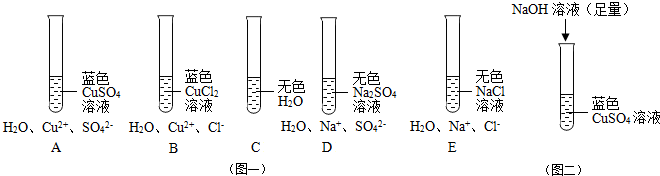
题目内容
(2012?绥化)同学们不难发现,现在的门窗已经不是以前的木制门窗,而是用新型合成材料(普通合成材料中加入某些添加剂)制成的塑钢门窗.不久的将来,我们教室内木制的座椅也会被轻便、美观、耐用的新型合成材料制成的座椅所取代.请你想一想制做的塑钢门窗或座椅所用的新型合成材料,应该具有怎样的性质?(请从安全、健康、耐用等方面答出三点即可)
分析:物质的性质决定物质的用途,而从物质的用途,我们也可判断物质的性质,根据制做的塑钢门窗或座椅所用的新型合成的用途对其性质进行分析,可主要从对人体的影响和它本身受环境的影响角度考虑.
解答:解:①从安全的角度考虑:制做的塑钢门窗或座椅所用的新型合成材料应该不能燃烧,以防止火灾的产生;
②从健康的角度考虑:因为它们常与人接触所以应该本身无毒,也不能散发有毒物质;
③从耐用的角度考虑:这种材料应该具有较强的稳定性,以便经久耐用;
答:①阻热性(不燃烧)②无毒(或不释放有毒气体或无特殊气味)③化学性质稳定(或抗氧化或不可降解).
②从健康的角度考虑:因为它们常与人接触所以应该本身无毒,也不能散发有毒物质;
③从耐用的角度考虑:这种材料应该具有较强的稳定性,以便经久耐用;
答:①阻热性(不燃烧)②无毒(或不释放有毒气体或无特殊气味)③化学性质稳定(或抗氧化或不可降解).
点评:此题是一道与生活实际相联系的题目,依据生活中常见物质的用途推断物质的性质一般要从安全环保及耐用等方面考虑,

练习册系列答案
相关题目
 (2012?太原)同学们在学习酸碱的化学性质时构建了如图知识网络,A、B、C、D是不同类别的无机化合物,“-”表示物质在一定条件下可以发生化学反应.请回答下列问题:
(2012?太原)同学们在学习酸碱的化学性质时构建了如图知识网络,A、B、C、D是不同类别的无机化合物,“-”表示物质在一定条件下可以发生化学反应.请回答下列问题: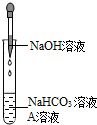 (2012?北京)同学们发现NaOH溶液与NaHCO3溶液混合后无明显现象,产生疑问:两种物质是否发生了化学反应?在老师的帮助下,他们通过以下探究过程证明NaHCO3溶液与NaOH溶液发生了反应.
(2012?北京)同学们发现NaOH溶液与NaHCO3溶液混合后无明显现象,产生疑问:两种物质是否发生了化学反应?在老师的帮助下,他们通过以下探究过程证明NaHCO3溶液与NaOH溶液发生了反应.