题目内容
某有机物4.4g在氧气中充分燃烧,生成13.2g二氧化碳和7.2g水.由此可确定该物质是由 元素组成的,如果该物质的相对分子质量是44,该物质的化学式为 .
| 根据质量守恒定律该物质燃烧生成二氧化碳和水可确定该物质中一定含有碳和氢元素,再根据二氧化碳的化学式求出二氧化碳中碳元素的质量,根据水的化学式求出水中氢元素的质量,两者之和与4.4g比较即可确定该有机物中是否含有氧元素;由有机物中元素的质量及有机物的相对分子质量32,推断有机物分子的构成而确定有机物的化学式. | |
| 解答: | 解:该物质燃烧生成二氧化碳和水,根据质量守恒定律可确定该物质中一定含有碳和氢元素; 13.2g二氧化碳中碳元素的质量为:13.2g× 7.2g水中氢元素的质量为:7.2g× 生成的二氧化碳中碳元素和水中氢元素的质量共为3.6g+0.8g=4.4g,所以该有机物中不含有氧元素; 该有机物中碳氢元素的质量比是3.6g:0.8g=9:2,设该有机物的化学式为CxHy,所以12x:y=9:2,x:y=3:8, 又该物质的相对分子质量是44,因此该物质的化学式为C3H8. 故答案为:碳、氢;C3H8. |

练习册系列答案
相关题目
化学上常用燃烧法测定有机物的组成.现取4.6g某有机物在足量氧气中充分燃烧,生成8.8g CO2和5.4g H2O,则该有机物中( )
| A、只含有碳、氢两种元素 | B、一定含有碳、氢、氧三种元素 | C、碳、氢元素的原子个数比为1:2 | D、碳、氢、氧元素的原子个数比为2:6:1 |
某有机物的相对分子质量为46,4.6g该物质在氧气中充分燃烧生成8.8g二氧化碳和5.4g水,据此判断,该有机物( )
| A、只由碳、氢两种元素组成 | B、一定含有碳、氢、氧三种元素 | C、化学式为CH2O2 | D、分子中C、Η、O原子个数比为2:6:1 |
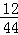 =3.6g,
=3.6g,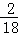 =0.8g,
=0.8g,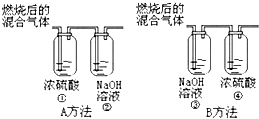 某有机物在氧气中充分燃烧,产物只有二氧化碳和水.甲、乙两组同学分别用A、B两种方法测定它们的组成,得到两组数据(如图所示).
某有机物在氧气中充分燃烧,产物只有二氧化碳和水.甲、乙两组同学分别用A、B两种方法测定它们的组成,得到两组数据(如图所示).