题目内容
(8分)我们周围的物质世界是由100多种元素组成的,为了便于研究元素的性质,常常需要寻找它们之间的内在规律。表1列出的是1~18号元素的部分最高正化合价和最低负化合价,请你阅读后回答下列问题:
|
1 H +1 |
|
2 He
|
|||||
|
3 Li +1 |
4 Be +2 |
5 B +3 |
6 C +4 ,—4 |
7 N +5 ,—3 |
8 O —2 |
9 F —1 |
10 Ne
|
|
11 Na +1 |
12 Mg +2 |
13 Al +3 |
14 Si +4 ,—4 |
15 P
|
16 S +6 ,—2 |
17 Cl +7 ,—1 |
18 Ar
|
(1)核电荷数为9的元素名称是 ① ,在化学反应中,该元素的原子容易 ② (填“得”或“失”)电子;
(2)16号元素属于______①____(填“金属”、“非金属”或“稀有气体”)元素,与该元素化学性质相似的另一元素是 ② 。 推测该元素的最低负化合价为____③____,最高正化合价的氧化物的化学式为_____④____。
(3) 表中不同元素间最本质的区别是__________________。
(4) 表中第三横行开头元素和靠近尾部元素的原子结构示意图分别为 和
和 ,它们的单质易发生如下图所示的变化
,它们的单质易发生如下图所示的变化

根据以上的信息,写出这两种元素形成的化合物的化学式为
(1) 氟元素 ; 得 (2)非金属 , 氧 , -2 , SO3 。
(3)质子数不同 (4) NaCl 。
【解析】(1)在原子中,核电荷数=质子数=原子序数,9号元素是氟元素,其结构示意图为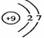 最外层为7个电子,易得电子。
最外层为7个电子,易得电子。
(2)16号元素为硫元素,是非金属元素,最外层电子数决定元素的化学性质,氧原子最外层电子数和硫原子一致,故化学性质相似;由图表可知,硫元素最低负价为-2,最高正价为+6价,故其最高正价的氧化物的化学式为SO3 。
(3)质子数决定元素的种类,故不同元素间最本质的区别就是质子数不同。
(4)11号和17号元素分别为钠元素和氯元素,二者形成的化合物的化学式为NaCl。


 和
和 ,它们的单质易发生如图所示的变化
,它们的单质易发生如图所示的变化